COPD治疗的最终目标是预防和控制症状、降低急性加重的严重程度和次数、改善呼吸能力从而增加运动耐量并降低死亡率。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 系统评价报告称,接受药物治疗的患者 FEV₁ 下降率略有降低。[78]Celli BR, Anderson JA, Cowans NJ, et al. Pharmacotherapy and lung function decline in patients with chronic obstructive pulmonary disease. A systematic review. Am J Respir Crit Care Med. 2021 Mar 15;203(6):689-98.https://www.atsjournals.org/doi/10.1164/rccm.202005-1854OChttp://www.ncbi.nlm.nih.gov/pubmed/32966751?tool=bestpractice.com[79]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com 然而,还需进一步研究以确定哪些患者最可能获益。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
现有阶梯治疗方法,应根据患者的一般健康状况和共存疾病制定个性化治疗方案。如果 COPD 患者合并哮喘,应主要根据哮喘指南进行管理。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 请参阅“成人哮喘” 。有关 α-1 抗胰蛋白酶缺乏症管理的详细信息,请参阅“α-1 抗胰蛋白酶缺乏症” 。
治疗方法包括减少危险因素暴露、恰当的疾病评估、患者教育、COPD稳定期的药物和非药物治疗以及COPD急性加重的预防和治疗。
世界卫生组织(World Health Organization, WHO)已发布了初级医疗机构稳定型 COPD 治疗最少干预措施。WHO: package of essential noncommunicable (PEN) disease interventions for primary health care
持续评估和监测疾病
对 COPD 进行持续监测和评估,可以确保实现治疗目标。当采用自我疾病监测或专业疾病监测时,生活质量和患者健康感将得到改善,住院人数将显著减少。[80]Lemmens KM, Nieboer AP, Huijsman R. A systematic review of integrated use of disease-management interventions in asthma and COPD. Respir Med. 2009 May;103(5):670-91.http://www.ncbi.nlm.nih.gov/pubmed/19155168?tool=bestpractice.com 病史评估应包括以下内容
危险因素的暴露和预防措施:
吸烟
室内和室外空气污染
职业暴露(烟雾、粉尘等)
流感和肺炎球菌疫苗接种
疾病进展和并发症的发生:
运动耐量下降
症状增多
睡眠质量下降
耽误工作或其他活动
药物治疗和其他治疗:
急救吸入剂的使用频率
任何新增加的药物治疗
医疗方案的依从性
正确应用吸入剂的能力
不良反应
急性加重病史
紧急治疗或急诊科就诊
近期大量口服皮质类固醇
应评估急性加重的频率、严重程度和可能的原因
合并症:
此外,每年应客观评估肺功能,如果症状显著增多,应增加肺功能检查频率。
一项 Cochrane 评价发现,由数位医务人员(包括物理治疗师、呼吸内科医生、护士等)和患者共同参与的疾病综合管理(integrated disease management, IDM)也许能够改善特定疾病生活质量、运动能力,减少患者住院,以及缩短人均住院日。[81]Poot CC, Meijer E, Kruis AL, et al. Integrated disease management interventions for patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Sep 8;(9):CD009437.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009437.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/34495549?tool=bestpractice.com [  ]What are the effects of integrated disease management (IDM) interventions for people with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.3877/full展示答案[证据 A]76ea49b7-0eff-463d-90da-4755f900cedfccaA对于慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者,综合疾病管理(integrated disease management, IDM)干预有何效用?
]What are the effects of integrated disease management (IDM) interventions for people with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.3877/full展示答案[证据 A]76ea49b7-0eff-463d-90da-4755f900cedfccaA对于慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者,综合疾病管理(integrated disease management, IDM)干预有何效用?
急性加重
COPD 急性加重是指特征为患者基线呼吸困难、咳嗽和/或咳痰情况超出正常的日常变化的事件,且为急性发作。请参阅“慢性阻塞性肺疾病急性加重” 。
长期管理:根据 GOLD 分组进行阶梯治疗
慢性阻塞性肺疾病全球倡议(Global Initiative for Chronic Obstructive Lung Disease, GOLD)指南建议根据诊断时患者的 GOLD 分组确定最初治疗:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
应为所有患者开处挽救性短效支气管舒张剂,以便立即缓解症状。短效支气管扩张剂无效可能意味着急性加重。
对于 A 组患者:症状少 (改良版英国医学研究委员会 [Modified British Medical Research Council, mMRC]分级为 0-1 或 COPD 评估测试[COPD Assessment Test, CAT]评分<10)且急性加重风险低 [每年急性加重 0-1 次,无需住院),可给予短效或长效支气管舒张剂作为一线治疗。首选长效 β2 受体激动剂(long-acting beta-2 agonist, LABA)和长效毒蕈碱受体拮抗剂(long-acting muscarinic antagonist, LAMA)而非短效支气管舒张剂,但仅偶尔出现呼吸困难的患者除外。
对于 B 组患者:症状较多(mMRC 分级≥2 或 CAT 评分≥10)而急性加重风险低(每年急性加重 0-1 次,无需住院),如无副作用或药物可及性问题,应将 LABA/LAMA 联合治疗作为一线治疗。否则可使用 LAMA 或 LABA 单药治疗。尚无证据表明哪一类长效支气管舒张剂作为支气管舒张剂单药治疗是最优的。应基于患者对症状缓解的感受进行选择。B 组患者可能伴有增加其症状并影响其预后的合并症,因此应考虑所有潜在合并症并进行相应检查。
对于 E 组患者:急性加重风险高 [每年急性加重≥2 次,或需要住院≥1 次] 且有任何严重的症状),如无不良反应或药物可及性问题,则将 LABA/LAMA 联合治疗作为一线治疗。如果患者的血嗜酸性粒细胞计数≥300 个细胞/μL,可以考虑在 LABA/LAMA 联合治疗的基础上加用吸入皮质类固醇(inhaled corticosteroid, ICS)(三联疗法)。不建议仅使用 ICS 与 LABA。
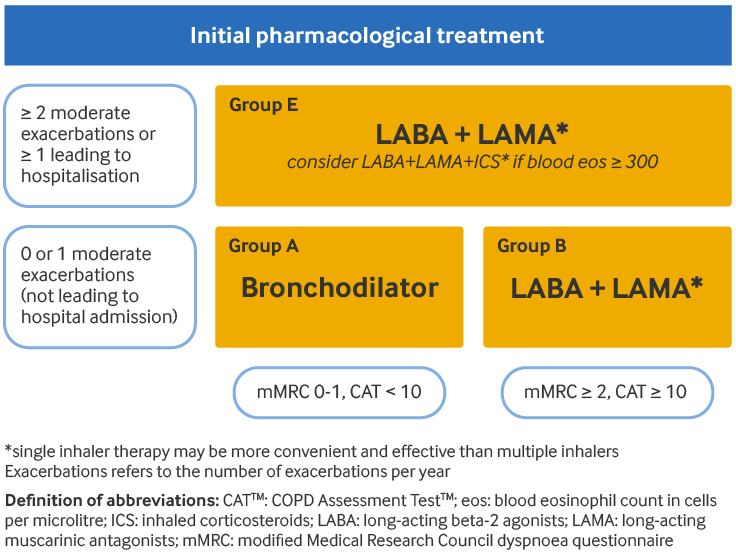 [Figure caption and citation for the preceding image starts]: COPD 的初始药物治疗 慢性阻塞性肺疾病全球倡议(GOLD):慢性阻塞性肺疾病诊断、治疗及预防全球策略(2023 年报告);获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: COPD 的初始药物治疗 慢性阻塞性肺疾病全球倡议(GOLD):慢性阻塞性肺疾病诊断、治疗及预防全球策略(2023 年报告);获准使用 [Citation ends].
后续治疗应根据患者的呼吸困难/运动受限症状负担以及复查后的急性加重频率确定,与诊断时患者的 GOLD 分组无关。GOLD 建议,应根据主要治疗目标是缓解呼吸困难/运动受限症状还是减少急性加重,采取不同的治疗路径。如果需要治疗达到这两个目的,则临床医师应遵循急性加重的治疗路径。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
进行任何治疗调整之前,应检查患者的症状和急性加重的风险,并对其吸入器使用技术和治疗依从性进行评估。还应对非药物治疗的作用进行评估。如果患者对初始治疗有适当的反应,则可维持初始治疗。药物治疗的调整可包括治疗升级或降级,以及改换吸入器装置或改用同一药物类别其他制剂。如果改变治疗方法,则临床医师应检查患者的临床反应以及所有潜在的不良反应。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
对于初始治疗后出现持续呼吸困难/运动受限的患者,建议升级治疗如下:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
对于初始治疗后出现持续性加重的患者,建议升级治疗如下:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
对于接受长效支气管舒张剂单药治疗的患者,应将治疗升级为 LABA/LAMA。血嗜酸性粒细胞计数有助于识别哪些患者更有可能对 ICS 有反应。[70]Bafadhel M, Peterson S, De Blas MA, et al. Predictors of exacerbation risk and response to budesonide in patients with chronic obstructive pulmonary disease: a post-hoc analysis of three randomised trials. Lancet Respir Med. 2018 Feb;6(2):117-26.http://www.ncbi.nlm.nih.gov/pubmed/29331313?tool=bestpractice.com[71]Harries TH, Rowland V, Corrigan CJ, et al. Blood eosinophil count, a marker of inhaled corticosteroid effectiveness in preventing COPD exacerbations in post-hoc RCT and observational studies: systematic review and meta-analysis. Respir Res. 2020 Jan 3;21(1):3.https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1268-7http://www.ncbi.nlm.nih.gov/pubmed/31900184?tool=bestpractice.com[72]Oshagbemi OA, Odiba JO, Daniel A, et al. Absolute blood eosinophil counts to guide inhaled corticosteroids therapy among patients with COPD: systematic review and meta-analysis. Curr Drug Targets. 2019;20(16):1670-9.http://www.ncbi.nlm.nih.gov/pubmed/31393244?tool=bestpractice.com 如果接受长效支气管舒张剂单药治疗的患者外周嗜酸性粒细胞计数≥300 个细胞/μL,则可以考虑升级至 LABA/LAMA/ICS 三联疗法。对于血嗜酸性粒细胞计数<100 个细胞/μL 的患者,ICS 不太可能有益。
在使用 LABA/LAMA 二联疗法的患者中,如果血嗜酸性粒细胞 ≥100 个细胞/μL,则应升级至使用 LABA/LAMA/ICS 三联疗法。多项研究显示,在中至重度 COPD 加重发生率和住院率方面,LABA/LAMA/ICS 三联疗法优于单药治疗或者 LABA/LAMA 或 LABA/ICS 二联疗法。[74]Cazzola M, Rogliani P, Calzetta L, et al. Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir J. 2018 Dec 13;52(6):1801586.https://erj.ersjournals.com/content/52/6/1801586http://www.ncbi.nlm.nih.gov/pubmed/30309975?tool=bestpractice.com[82]Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting beta2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet. 2016 Sep 3;388(10048):963-73.http://www.ncbi.nlm.nih.gov/pubmed/27598678?tool=bestpractice.com[83]Vestbo J, Papi A, Corradi M, et al. Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a double-blind, parallel group, randomised controlled trial. Lancet. 2017 May 13;389(10082):1919-29.http://www.ncbi.nlm.nih.gov/pubmed/28385353?tool=bestpractice.com[84]Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018 Mar 17;391(10125):1076-84.http://www.ncbi.nlm.nih.gov/pubmed/29429593?tool=bestpractice.com[85]Lipson DA, Barnacle H, Birk R, et al. FULFIL Trial: once-daily triple therapy for patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2017 Aug 15;196(4):438-46.https://www.atsjournals.org/doi/full/10.1164/rccm.201703-0449OChttp://www.ncbi.nlm.nih.gov/pubmed/28375647?tool=bestpractice.com[86]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.https://www.nejm.org/doi/10.1056/NEJMoa1713901http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com[87]Rojas-Reyes MX, García Morales OM, Dennis RJ, et al. Combination inhaled steroid and long-acting beta₂-agonist in addition to tiotropium versus tiotropium or combination alone for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Jun 6;(6):CD008532.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD008532.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27271056?tool=bestpractice.com[88]Lai CC, Chen CH, Lin CYH, et al. The effects of single inhaler triple therapy vs single inhaler dual therapy or separate triple therapy for the management of chronic obstructive pulmonary disease: a systematic review and meta-analysis of randomized controlled trials. Int J Chron Obstruct Pulmon Dis. 2019 Jul 11;14:1539-48. [Erratum in: Int J Chron Obstruct Pulmon Dis. 2020 Jan 21;15:155-6.]https://www.dovepress.com/the-effects-of-single-inhaler-triple-therapy-vs-single-inhaler-dual-th-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/31371939?tool=bestpractice.com[89]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com 美国胸科学会指南建议,对于尽管接受 LABA/LAMA 二联治疗,但是在过去一年中仍因一次或多次急性加重而需要使用口服皮质类固醇、抗生素或需要住院,并且有呼吸困难或运动耐量下降的患者,应使用三联治疗。[90]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.https://www.atsjournals.org/doi/10.1164/rccm.202003-0625SThttp://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com 英国指南建议,对于接受 LABA/LAMA 二联治疗后在一年内仍出现需要住院治疗的加重或者出现两次中度加重的患者,应使用三联治疗。[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].https://www.nice.org.uk/guidance/ng115
接受 LABA/LAMA 治疗的患者如果血嗜酸性粒细胞 <100 个细胞/μL,应加用 roflumilast 或阿奇霉素。
GOLD 不推荐使用 LABA/ICS。但是,如果无哮喘特征的 COPD 患者已接受 LABA/ICS 治疗且控制良好,则可以继续使用。如果患者有进一步加重,则应加用 LAMA,升级为三联疗法。如果患者出现严重症状,可改用 LABA/LAMA。
采用 LABA/LAMA/ICS 治疗的患者,可加用罗氟司特或阿奇霉素。第 1 秒用力呼气容积(forced expiratory volume in 1 second, FEV₁)<50% 预测值,且伴慢性支气管炎,尤其是之前一年至少出现一次因急性加重而住院治疗者,可考虑给予罗氟司特。开具阿奇霉素时,应考虑产生抗生素耐药性微生物风险。如果 ICS 无效或引起不良反应,可予停用。停用 ICS 后,血嗜酸性粒细胞≥300 个细胞/μL 的患者出现急性加重的风险最高。[75]Chapman KR, Hurst JR, Frent SM, et al. Long-term triple therapy de-escalation to indacaterol/glycopyrronium in patients with chronic obstructive pulmonary disease (SUNSET): a randomized, double-blind, triple-dummy clinical trial. Am J Respir Crit Care Med. 2018 Aug 1;198(3):329-39.https://www.atsjournals.org/doi/10.1164/rccm.201803-0405OChttp://www.ncbi.nlm.nih.gov/pubmed/29779416?tool=bestpractice.com
所有患者都应该接受患者教育、疫苗接种和戒烟干预。
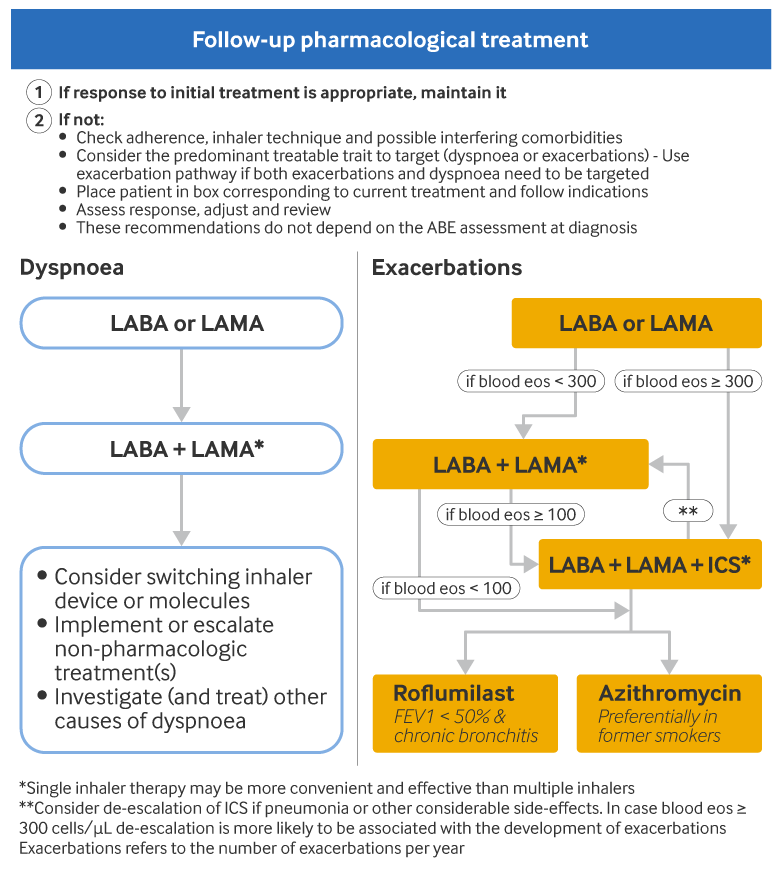 [Figure caption and citation for the preceding image starts]: COPD 患者的升级治疗。缩略词含义:ICS——吸入皮质类固醇;LABA——长效 β2 受体激动剂;LAMA——长效毒蕈碱受体拮抗剂 慢性阻塞性肺疾病全球倡议(GOLD):慢性阻塞性肺疾病诊断、治疗及预防全球策略(2023 年报告);获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: COPD 患者的升级治疗。缩略词含义:ICS——吸入皮质类固醇;LABA——长效 β2 受体激动剂;LAMA——长效毒蕈碱受体拮抗剂 慢性阻塞性肺疾病全球倡议(GOLD):慢性阻塞性肺疾病诊断、治疗及预防全球策略(2023 年报告);获准使用 [Citation ends].
支气管扩张剂
β-2 受体激动剂被广泛用于 COPD 的治疗。此类药物可增加细胞 cAMP,使呼吸道平滑肌舒张并降低气道阻力。毒蕈碱受体拮抗剂(抗胆碱能类药物)通过阻断呼吸道平滑肌胆碱能受体,发挥支气管扩张剂作用。其可松弛肌肉,并减轻气流受限。因此,β 受体激动剂和毒蕈碱受体拮抗剂通过不同途径起到支气管扩张剂作用。两种药物均已有短效和长效制剂。
短效 β-2 受体激动剂(例如沙丁胺醇)和短效毒蕈碱受体拮抗剂(例如异丙托溴铵)能改善肺功能、减轻呼吸困难和提升生活质量。异丙托溴铵在改善健康相关生活质量方面的益处略高于短效 β-2 受体激动剂。[91]Appleton S, Jones T, Poole P, et al. Ipratropium bromide versus short acting beta-2 agonists for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2006 Apr 19;(2):CD001387.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001387.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/16625543?tool=bestpractice.com 如果患者使用长效支气管舒张剂治疗,这些药物可用作挽救治疗;还可以将其用作 GOLD A 组患者的初始治疗,前提是患者仅偶尔出现呼吸困难。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[92]Chen AM, Bollmeier SG, Finnegan PM, et al. Long-acting bronchodilator therapy for the treatment of chronic obstructive pulmonary disease. Ann Pharmacother. 2008 Dec;42(12):1832-42.http://www.ncbi.nlm.nih.gov/pubmed/18957624?tool=bestpractice.com 然而,一般不推荐常规使用短效支气管舒张剂。
现已证明,噻托溴铵(一种长效毒蕈碱受体拮抗剂 [LAMA])与安慰剂或其他维持治疗相比,可降低病情加重的风险。[93]Halpin DM, Vogelmeier C, Pieper MP, et al. Effect of tiotropium on COPD exacerbations: a systematic review. Respir Med. 2016 May;114:1-8.https://www.resmedjournal.com/article/S0954-6111(16)30030-0/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/27109805?tool=bestpractice.com [  ]How does tiotropium compare with ipratropium bromide for people with chronic obstructive pulmonary disease (COPD)?https://cochranelibrary.com/cca/doi/10.1002/cca.2154/full展示答案 如阿地溴铵、格隆溴铵、乌美铵等新一代 LAMA,对于改变 FEV₁ 谷值基线、过渡呼吸困难指数焦点评分、St George 呼吸问卷评分和抢救药物使用,具有与噻托溴铵至少相当的效力。[94]Ismaila AS, Huisman EL, Punekar YS, et al. Comparative efficacy of long-acting muscarinic antagonist monotherapies in COPD: a systematic review and network meta-analysis. Int J Chron Obstruct Pulmon Dis. 2015 Nov 16;10(1):2495-517.https://www.dovepress.com/comparative-efficacy-of-long-acting-muscarinic-antagonist-monotherapie-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/26604738?tool=bestpractice.com revefenacin 是一种雾化用 LAMA,获批用于中至重度 COPD 的维持治疗。一些关于使用短效毒蕈碱受体拮抗剂患者的研究和使用 LAMA 患者的研究发现,心血管相关死亡率有所增加。[95]Hilleman DE, Malesker MA, Morrow LE, et al. A systematic review of the cardiovascular risk of inhaled anticholinergics in patients with COPD. Int J Chron Obstruct Pulmon Dis. 2009 Jun 29;4:253-63.https://www.dovepress.com/getfile.php?fileID=5012http://www.ncbi.nlm.nih.gov/pubmed/19657399?tool=bestpractice.com[96]Wang MT, Liou JT, Lin CW, et al. Association of cardiovascular risk with inhaled long-acting bronchodilators in patients with chronic obstructive pulmonary disease: a nested case-control study. JAMA Intern Med. 2018 Feb 1;178(2):229-38.https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2666790http://www.ncbi.nlm.nih.gov/pubmed/29297057?tool=bestpractice.com 一项研究得出结论,与安慰剂相比,阿地溴铵与主要不良心血管事件的增加无关。[97]Wise RA, Chapman KR, Scirica BM, et al. Effect of aclidinium bromide on major cardiovascular events and exacerbations in high-risk patients with chronic obstructive pulmonary disease: the ASCENT-COPD randomized clinical trial. JAMA. 2019 May 7;321(17):1693-701.https://jamanetwork.com/journals/jama/fullarticle/2732574http://www.ncbi.nlm.nih.gov/pubmed/31063575?tool=bestpractice.com 一项基于人群的队列研究发现,最近开始接受 LAMA 治疗的 COPD 老年男性患者发生泌尿道感染的风险增加。[98]Gershon AS, Newman AM, Fischer HD, et al. Inhaled long-acting anticholinergics and urinary tract infection in individuals with COPD. COPD. 2017 Feb;14(1):105-12.http://www.ncbi.nlm.nih.gov/pubmed/27732117?tool=bestpractice.com
]How does tiotropium compare with ipratropium bromide for people with chronic obstructive pulmonary disease (COPD)?https://cochranelibrary.com/cca/doi/10.1002/cca.2154/full展示答案 如阿地溴铵、格隆溴铵、乌美铵等新一代 LAMA,对于改变 FEV₁ 谷值基线、过渡呼吸困难指数焦点评分、St George 呼吸问卷评分和抢救药物使用,具有与噻托溴铵至少相当的效力。[94]Ismaila AS, Huisman EL, Punekar YS, et al. Comparative efficacy of long-acting muscarinic antagonist monotherapies in COPD: a systematic review and network meta-analysis. Int J Chron Obstruct Pulmon Dis. 2015 Nov 16;10(1):2495-517.https://www.dovepress.com/comparative-efficacy-of-long-acting-muscarinic-antagonist-monotherapie-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/26604738?tool=bestpractice.com revefenacin 是一种雾化用 LAMA,获批用于中至重度 COPD 的维持治疗。一些关于使用短效毒蕈碱受体拮抗剂患者的研究和使用 LAMA 患者的研究发现,心血管相关死亡率有所增加。[95]Hilleman DE, Malesker MA, Morrow LE, et al. A systematic review of the cardiovascular risk of inhaled anticholinergics in patients with COPD. Int J Chron Obstruct Pulmon Dis. 2009 Jun 29;4:253-63.https://www.dovepress.com/getfile.php?fileID=5012http://www.ncbi.nlm.nih.gov/pubmed/19657399?tool=bestpractice.com[96]Wang MT, Liou JT, Lin CW, et al. Association of cardiovascular risk with inhaled long-acting bronchodilators in patients with chronic obstructive pulmonary disease: a nested case-control study. JAMA Intern Med. 2018 Feb 1;178(2):229-38.https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2666790http://www.ncbi.nlm.nih.gov/pubmed/29297057?tool=bestpractice.com 一项研究得出结论,与安慰剂相比,阿地溴铵与主要不良心血管事件的增加无关。[97]Wise RA, Chapman KR, Scirica BM, et al. Effect of aclidinium bromide on major cardiovascular events and exacerbations in high-risk patients with chronic obstructive pulmonary disease: the ASCENT-COPD randomized clinical trial. JAMA. 2019 May 7;321(17):1693-701.https://jamanetwork.com/journals/jama/fullarticle/2732574http://www.ncbi.nlm.nih.gov/pubmed/31063575?tool=bestpractice.com 一项基于人群的队列研究发现,最近开始接受 LAMA 治疗的 COPD 老年男性患者发生泌尿道感染的风险增加。[98]Gershon AS, Newman AM, Fischer HD, et al. Inhaled long-acting anticholinergics and urinary tract infection in individuals with COPD. COPD. 2017 Feb;14(1):105-12.http://www.ncbi.nlm.nih.gov/pubmed/27732117?tool=bestpractice.com
LABA 和 LAMA 均可显著改善肺功能、呼吸困难和健康状况,还能减少加重频率。 [  ]How does umeclidinium bromide compare with placebo for people with chronic obstructive pulmonary disease (COPD)?https://cochranelibrary.com/cca/doi/10.1002/cca.1829/full展示答案[证据 A]81c5e462-8f36-4687-93b0-cd4b9989ab2accaA对于慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者,乌美铵与安慰剂相比效果如何? 对于稳定期 COPD 患者,如果决定采取单药治疗,LAMA 可能优于 LABA。[99]Rabe KF, Timmer W, Sagkriotis A, et al. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008 Aug;134(2):255-62.http://www.ncbi.nlm.nih.gov/pubmed/18403672?tool=bestpractice.com 对于中至极重度 COPD 患者,与 LABA 相比,LAMA 能更有效地减少加重。[100]Vogelmeier C, Hederer B, Glaab T, et al; POET-COPD Investigators. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med. 2011 Mar 24;364(12):1093-103.https://www.nejm.org/doi/full/10.1056/NEJMoa1008378http://www.ncbi.nlm.nih.gov/pubmed/21428765?tool=bestpractice.com[101]Decramer ML, Chapman KR, Dahl R, et al; INVIGORATE investigators. Once-daily indacaterol versus tiotropium for patients with severe chronic obstructive pulmonary disease (INVIGORATE): a randomised, blinded, parallel-group study. Lancet Respir Med. 2013 Sep;1(7):524-33.http://www.ncbi.nlm.nih.gov/pubmed/24461613?tool=bestpractice.com UPLIFT 试验证明了 LAMA 的长期安全性。[102]Celli B, Decramer M, Kesten S, et al. UPLIFT Study Investigators. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009 Nov 15;180(10):948-55.https://www.atsjournals.org/doi/full/10.1164/rccm.200906-0876OChttp://www.ncbi.nlm.nih.gov/pubmed/19729663?tool=bestpractice.com
]How does umeclidinium bromide compare with placebo for people with chronic obstructive pulmonary disease (COPD)?https://cochranelibrary.com/cca/doi/10.1002/cca.1829/full展示答案[证据 A]81c5e462-8f36-4687-93b0-cd4b9989ab2accaA对于慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者,乌美铵与安慰剂相比效果如何? 对于稳定期 COPD 患者,如果决定采取单药治疗,LAMA 可能优于 LABA。[99]Rabe KF, Timmer W, Sagkriotis A, et al. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008 Aug;134(2):255-62.http://www.ncbi.nlm.nih.gov/pubmed/18403672?tool=bestpractice.com 对于中至极重度 COPD 患者,与 LABA 相比,LAMA 能更有效地减少加重。[100]Vogelmeier C, Hederer B, Glaab T, et al; POET-COPD Investigators. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med. 2011 Mar 24;364(12):1093-103.https://www.nejm.org/doi/full/10.1056/NEJMoa1008378http://www.ncbi.nlm.nih.gov/pubmed/21428765?tool=bestpractice.com[101]Decramer ML, Chapman KR, Dahl R, et al; INVIGORATE investigators. Once-daily indacaterol versus tiotropium for patients with severe chronic obstructive pulmonary disease (INVIGORATE): a randomised, blinded, parallel-group study. Lancet Respir Med. 2013 Sep;1(7):524-33.http://www.ncbi.nlm.nih.gov/pubmed/24461613?tool=bestpractice.com UPLIFT 试验证明了 LAMA 的长期安全性。[102]Celli B, Decramer M, Kesten S, et al. UPLIFT Study Investigators. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009 Nov 15;180(10):948-55.https://www.atsjournals.org/doi/full/10.1164/rccm.200906-0876OChttp://www.ncbi.nlm.nih.gov/pubmed/19729663?tool=bestpractice.com
使用 LABA/LAMA 二联治疗可能获得更好的治疗效果,且不会增加其中各类药物的不良反应。[99]Rabe KF, Timmer W, Sagkriotis A, et al. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008 Aug;134(2):255-62.http://www.ncbi.nlm.nih.gov/pubmed/18403672?tool=bestpractice.com[103]Tashkin DP, Littner M, Andrews CP, et al. Concomitant treatment with nebulized formoterol and tiotropium in subjects with COPD: a placebo-controlled trial. Respir Med. 2008 Apr;102(4):479-87.http://www.ncbi.nlm.nih.gov/pubmed/18258423?tool=bestpractice.com[104]Tashkin DP, Pearle J, Iezzoni D, et al. Formoterol and tiotropium compared with tiotropium alone for treatment of COPD. COPD. 2009 Feb;6(1):17-25.http://www.ncbi.nlm.nih.gov/pubmed/19229704?tool=bestpractice.com[105]Vogelmeier C, Kardos P, Harari S, et al. Formoterol mono- and combination therapy with tiotropium in patients with COPD: a 6-month study. Respir Med. 2008 Nov;102(11):1511-20.http://www.ncbi.nlm.nih.gov/pubmed/18804362?tool=bestpractice.com[106]Maltais F, Bjermer L, Kerwin EM, et al. Efficacy of umeclidinium/vilanterol versus umeclidinium and salmeterol monotherapies in symptomatic patients with COPD not receiving inhaled corticosteroids: the EMAX randomised trial. Respir Res. 2019 Oct 30;20(1):238.https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1193-9http://www.ncbi.nlm.nih.gov/pubmed/31666084?tool=bestpractice.com乌美溴铵/维兰特罗、格隆溴铵/福莫特罗、噻托溴铵/奥达特罗和阿地溴铵/福莫特罗已获批用于治疗 COPD。系统评价和荟萃分析发现,LABA/LAMA 联合治疗:
与单药治疗相比,可降低急性加重率
与安慰剂相比,可为轻度/中度 COPD 患者带来有显著临床意义的肺功能和健康相关的生存质量改善[107]Maqsood U, Ho TN, Palmer K, et al. Once daily long-acting beta2-agonists and long-acting muscarinic antagonists in a combined inhaler versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 Mar 6;(3):CD012930.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012930.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/30839102?tool=bestpractice.com [  ]How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/full展示答案
]How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/full展示答案
可改善稳定期 COPD 患者的 FEV₁ 并小幅降低其肺炎风险,但使全因死亡率从 1% 增至 1.4%。[108]Fukuda N, Horita N, Kaneko A, et al. Long-acting muscarinic antagonist (LAMA) plus long-acting beta-agonist (LABA) versus LABA plus inhaled corticosteroid (ICS) for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Jun 5;6(6):CD012066.https://www.doi.org/10.1002/14651858.CD012066.pub3http://www.ncbi.nlm.nih.gov/pubmed/37276335?tool=bestpractice.com [  ]How does long‐acting muscarinic antagonist (LAMA) plus long‐acting beta‐agonist (LABA) compare with LABA plus inhaled corticosteroid (ICS) for people with stable chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.4356/full展示答案
]How does long‐acting muscarinic antagonist (LAMA) plus long‐acting beta‐agonist (LABA) compare with LABA plus inhaled corticosteroid (ICS) for people with stable chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.4356/full展示答案
乌美溴铵/维兰特罗能降低轻度/中度 COPD 患者的加重风险。[107]Maqsood U, Ho TN, Palmer K, et al. Once daily long-acting beta2-agonists and long-acting muscarinic antagonists in a combined inhaler versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 Mar 6;(3):CD012930.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012930.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/30839102?tool=bestpractice.com [  ]How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/full展示答案 一项系统评价和网络荟萃分析发现,所有 LABA/LAMA 固定剂量复方制剂都具有相似的有效性和安全性。[109]Schlueter M, Gonzalez-Rojas N, Baldwin M, et al. Comparative efficacy of fixed-dose combinations of long-acting muscarinic antagonists and long-acting beta2-agonists: a systematic review and network meta-analysis. Ther Adv Respir Dis. 2016 Apr;10(2):89-104.https://journals.sagepub.com/doi/10.1177/1753465815624612http://www.ncbi.nlm.nih.gov/pubmed/26746383?tool=bestpractice.com
]How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/full展示答案 一项系统评价和网络荟萃分析发现,所有 LABA/LAMA 固定剂量复方制剂都具有相似的有效性和安全性。[109]Schlueter M, Gonzalez-Rojas N, Baldwin M, et al. Comparative efficacy of fixed-dose combinations of long-acting muscarinic antagonists and long-acting beta2-agonists: a systematic review and network meta-analysis. Ther Adv Respir Dis. 2016 Apr;10(2):89-104.https://journals.sagepub.com/doi/10.1177/1753465815624612http://www.ncbi.nlm.nih.gov/pubmed/26746383?tool=bestpractice.com
如上所述,GOLD 根据患者的风险分组(A、B 或 E)给出初始药物治疗建议。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 对于有呼吸困难或运动不耐受的 COPD 患者,美国胸科学会(American Thoracic Society)指南建议优选 LABA/LAMA,而不是单药治疗。[90]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.https://www.atsjournals.org/doi/10.1164/rccm.202003-0625SThttp://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com 英国指南建议,如果患者给予非药物治疗后,仍有症状或出现病情加重,应起始 LABA/LAMA 或 LABA/ICS 双治疗,并根据需要给予短效支气管扩张剂。英国指南中的初始用药方案选择基于患者是否具有哮喘特征,或是否具有提示皮质类固醇反应性的特征。[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].https://www.nice.org.uk/guidance/ng115
吸入皮质类固醇(ICS)
当 COPD 患者有指征时,ICS 应始终与长效支气管扩张剂联合使用。ICS 由于其抗炎作用,因此被认为有效。长期使用 ICS 能够减少对挽救治疗的需要、减少加重次数,并有可能降低患者死亡率。[110]Spencer S, Calverley PM, Burge PS, et al. Impact of preventing exacerbations on deterioration of health status in COPD. Eur Respir J. 2004 May;23(5):698-702.https://erj.ersjournals.com/content/23/5/698http://www.ncbi.nlm.nih.gov/pubmed/15176682?tool=bestpractice.com[111]Sin DD, Wu L, Anderson JA, et al. Inhaled corticosteroids and mortality in chronic obstructive pulmonary disease. Thorax. 2005 Dec;60(12):992-7.http://www.ncbi.nlm.nih.gov/pubmed/16227327?tool=bestpractice.com[112]Lee HW, Park J, Jo J, et al. Comparisons of exacerbations and mortality among regular inhaled therapies for patients with stable chronic obstructive pulmonary disease: systematic review and Bayesian network meta-analysis. PLoS Med. 2019 Nov;16(11):e1002958.https://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1002958http://www.ncbi.nlm.nih.gov/pubmed/31730642?tool=bestpractice.com
含 ICS 的治疗方案对于具有加重高风险(前一年出现两次或两次以上加重和/或一次因加重而住院)的患者效力较高。[84]Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018 Mar 17;391(10125):1076-84.http://www.ncbi.nlm.nih.gov/pubmed/29429593?tool=bestpractice.com[86]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.https://www.nejm.org/doi/10.1056/NEJMoa1713901http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com[113]Wedzicha JA, Banerji D, Chapman KR, et al; FLAME Investigators. Indacaterol-glycopyrronium versus salmeterol-fluticasone for COPD. N Engl J Med. 2016 Jun 9;374(23):2222-34.https://www.nejm.org/doi/10.1056/NEJMoa1516385http://www.ncbi.nlm.nih.gov/pubmed/27181606?tool=bestpractice.com 血嗜酸性粒细胞计数可预测常规长效支气管舒张剂治疗联合 ICS 用于预防急性加重的疗效。[71]Harries TH, Rowland V, Corrigan CJ, et al. Blood eosinophil count, a marker of inhaled corticosteroid effectiveness in preventing COPD exacerbations in post-hoc RCT and observational studies: systematic review and meta-analysis. Respir Res. 2020 Jan 3;21(1):3.https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1268-7http://www.ncbi.nlm.nih.gov/pubmed/31900184?tool=bestpractice.com[72]Oshagbemi OA, Odiba JO, Daniel A, et al. Absolute blood eosinophil counts to guide inhaled corticosteroids therapy among patients with COPD: systematic review and meta-analysis. Curr Drug Targets. 2019;20(16):1670-9.http://www.ncbi.nlm.nih.gov/pubmed/31393244?tool=bestpractice.com[73]Pascoe S, Barnes N, Brusselle G, et al. Blood eosinophils and treatment response with triple and dual combination therapy in chronic obstructive pulmonary disease: analysis of the IMPACT trial. Lancet Respir Med. 2019 Sep;7(9):745-56.http://www.ncbi.nlm.nih.gov/pubmed/31281061?tool=bestpractice.com 血嗜酸性粒细胞计数<100 个细胞/μL 时,疗效甚微或无效,而血嗜酸性粒细胞计数≥300 个细胞/μL 时,疗效最佳。[70]Bafadhel M, Peterson S, De Blas MA, et al. Predictors of exacerbation risk and response to budesonide in patients with chronic obstructive pulmonary disease: a post-hoc analysis of three randomised trials. Lancet Respir Med. 2018 Feb;6(2):117-26.http://www.ncbi.nlm.nih.gov/pubmed/29331313?tool=bestpractice.com[74]Cazzola M, Rogliani P, Calzetta L, et al. Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir J. 2018 Dec 13;52(6):1801586.https://erj.ersjournals.com/content/52/6/1801586http://www.ncbi.nlm.nih.gov/pubmed/30309975?tool=bestpractice.com 这些阈值是可能有助于临床医师预测治疗获益可能性的近似临界值。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 无论嗜酸性粒细胞计数如何,既往曾吸烟者都要比当前吸烟者对皮质类固醇的反应更强。[73]Pascoe S, Barnes N, Brusselle G, et al. Blood eosinophils and treatment response with triple and dual combination therapy in chronic obstructive pulmonary disease: analysis of the IMPACT trial. Lancet Respir Med. 2019 Sep;7(9):745-56.http://www.ncbi.nlm.nih.gov/pubmed/31281061?tool=bestpractice.com 以肺功能和加重率而言,罹患 COPD 的当前吸烟者和既往曾吸烟者均可获益于 ICS 治疗,然而,与轻度吸烟者和既往曾吸烟者相比,其对重度吸烟者或当前吸烟者效力较轻。[86]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.https://www.nejm.org/doi/10.1056/NEJMoa1713901http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com[114]Sonnex K, Alleemudder H, Knaggs R. Impact of smoking status on the efficacy of inhaled corticosteroids in chronic obstructive pulmonary disease: a systematic review. BMJ Open. 2020 Apr 15;10(4):e037509.https://bmjopen.bmj.com/content/10/4/e037509http://www.ncbi.nlm.nih.gov/pubmed/32300001?tool=bestpractice.com 短期 ICS 使用(≤1 年)可能比长期使用更能改善 FEV₁,但需行进一步研究,从而更深入了解治疗对肺功能的影响。[115]Whittaker HR, Jarvis D, Sheikh MR, et al. Inhaled corticosteroids and FEV1 decline in chronic obstructive pulmonary disease: a systematic review. Respir Res. 2019 Dec 4;20(1):277.https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1249-xhttp://www.ncbi.nlm.nih.gov/pubmed/31801539?tool=bestpractice.com
若干研究指出,COPD 患者使用 ICS 可使肺炎发生风险升高。[79]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com [  ]What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/full展示答案 与使用布地奈德相比,使用氟替卡松的这种风险更高。[116]Suissa S, Patenaude V, Lapi F, et al. Inhaled corticosteroids in COPD and the risk of serious pneumonia. Thorax. 2013 Nov;68(11):1029-36.https://thorax.bmj.com/content/68/11/1029.longhttp://www.ncbi.nlm.nih.gov/pubmed/24130228?tool=bestpractice.com[117]Lodise TP, Li J, Gandhi HN, et al. Intraclass difference in pneumonia risk with fluticasone and budesonide in COPD: a systematic review of evidence from direct-comparison studies. Int J Chron Obstruct Pulmon Dis. 2020 Nov 11;15:2889-900.https://www.dovepress.com/intraclass-difference-in-pneumonia-risk-with-fluticasone-and-budesonid-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/33204085?tool=bestpractice.com[118]Yang M, Du Y, Chen H, et al. Inhaled corticosteroids and risk of pneumonia in patients with chronic obstructive pulmonary disease: a meta-analysis of randomized controlled trials. Int Immunopharmacol. 2019 Dec;77:105950.http://www.ncbi.nlm.nih.gov/pubmed/31629940?tool=bestpractice.com 一项有关丹麦患者的大型队列研究发现,感染铜绿假单胞菌(医院获得性肺炎的常见原因)风险具有剂量依赖性,其中高剂量 ICS 的风险大。该研究还发现,与铜绿假单胞菌阴性患者相比,感染铜绿假单胞菌患者的 BMI 和 FEV₁ 更可能较低。[119]Eklöf J, Ingebrigtsen TS, Sørensen R, et al. Use of inhaled corticosteroids and risk of acquiring Pseudomonas aeruginosa in patients with chronic obstructive pulmonary disease. Thorax. 2022 Jun;77(6):573-80.https://thorax.bmj.com/content/77/6/573http://www.ncbi.nlm.nih.gov/pubmed/34446524?tool=bestpractice.com 一项系统评价和荟萃分析发现,尽管使用 ICS 与未经调整的肺炎风险显著增加有关,但在随机对照临床试验中,ICS 并未引起肺炎致死率和总体死亡率增加,在一些观察性研究中肺炎致死率和总体死亡率反而有所降低。[120]Festic E, Bansal V, Gupta E, et al. Association of inhaled corticosteroids with incident pneumonia and mortality in COPD patients; systematic review and meta-analysis. COPD. 2016 Jun;13(3):312-26.https://www.tandfonline.com/doi/full/10.3109/15412555.2015.1081162http://www.ncbi.nlm.nih.gov/pubmed/26645797?tool=bestpractice.com 因此,应该评估肺炎的风险和减少急性加重的获益来实施个体化治疗。[79]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com[121]Welte T. Inhaled corticosteroids in COPD and the risk of pneumonia. Lancet. 2009 Aug 29;374(9691):668-70.http://www.ncbi.nlm.nih.gov/pubmed/19716946?tool=bestpractice.com[122]Kew KM, Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014 Mar 10;(3):CD010115.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010115.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/24615270?tool=bestpractice.com 接受 ICS 治疗的 COPD 成人患者中,结核病和流感风险的升高也引发了关注,但一项荟萃分析发现,所有经评估的结核病病例中,仅不到 1% 的病例可归因于 ICS 暴露。[123]Dong YH, Chang CH, Lin Wu FL, et al. Use of inhaled corticosteroids in patients with COPD and the risk of TB and influenza: a systematic review and meta-analysis of randomized controlled trials. Chest. 2014 Jun;145(6):1286-97.http://www.ncbi.nlm.nih.gov/pubmed/24504044?tool=bestpractice.com[124]Castellana G, Castellana M, Castellana C, et al. Inhaled corticosteroids and risk of tuberculosis in patients with obstructive lung diseases: a systematic review and meta-analysis of non-randomized studies. Int J Chron Obstruct Pulmon Dis. 2019 Sep 26;14:2219-27.https://www.dovepress.com/inhaled-corticosteroids-and-risk-of-tuberculosis-in-patients-with-obst-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/31576118?tool=bestpractice.com ICS 也可能引起口咽念珠菌病病和声音嘶哑。[79]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com [
]What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/full展示答案 与使用布地奈德相比,使用氟替卡松的这种风险更高。[116]Suissa S, Patenaude V, Lapi F, et al. Inhaled corticosteroids in COPD and the risk of serious pneumonia. Thorax. 2013 Nov;68(11):1029-36.https://thorax.bmj.com/content/68/11/1029.longhttp://www.ncbi.nlm.nih.gov/pubmed/24130228?tool=bestpractice.com[117]Lodise TP, Li J, Gandhi HN, et al. Intraclass difference in pneumonia risk with fluticasone and budesonide in COPD: a systematic review of evidence from direct-comparison studies. Int J Chron Obstruct Pulmon Dis. 2020 Nov 11;15:2889-900.https://www.dovepress.com/intraclass-difference-in-pneumonia-risk-with-fluticasone-and-budesonid-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/33204085?tool=bestpractice.com[118]Yang M, Du Y, Chen H, et al. Inhaled corticosteroids and risk of pneumonia in patients with chronic obstructive pulmonary disease: a meta-analysis of randomized controlled trials. Int Immunopharmacol. 2019 Dec;77:105950.http://www.ncbi.nlm.nih.gov/pubmed/31629940?tool=bestpractice.com 一项有关丹麦患者的大型队列研究发现,感染铜绿假单胞菌(医院获得性肺炎的常见原因)风险具有剂量依赖性,其中高剂量 ICS 的风险大。该研究还发现,与铜绿假单胞菌阴性患者相比,感染铜绿假单胞菌患者的 BMI 和 FEV₁ 更可能较低。[119]Eklöf J, Ingebrigtsen TS, Sørensen R, et al. Use of inhaled corticosteroids and risk of acquiring Pseudomonas aeruginosa in patients with chronic obstructive pulmonary disease. Thorax. 2022 Jun;77(6):573-80.https://thorax.bmj.com/content/77/6/573http://www.ncbi.nlm.nih.gov/pubmed/34446524?tool=bestpractice.com 一项系统评价和荟萃分析发现,尽管使用 ICS 与未经调整的肺炎风险显著增加有关,但在随机对照临床试验中,ICS 并未引起肺炎致死率和总体死亡率增加,在一些观察性研究中肺炎致死率和总体死亡率反而有所降低。[120]Festic E, Bansal V, Gupta E, et al. Association of inhaled corticosteroids with incident pneumonia and mortality in COPD patients; systematic review and meta-analysis. COPD. 2016 Jun;13(3):312-26.https://www.tandfonline.com/doi/full/10.3109/15412555.2015.1081162http://www.ncbi.nlm.nih.gov/pubmed/26645797?tool=bestpractice.com 因此,应该评估肺炎的风险和减少急性加重的获益来实施个体化治疗。[79]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com[121]Welte T. Inhaled corticosteroids in COPD and the risk of pneumonia. Lancet. 2009 Aug 29;374(9691):668-70.http://www.ncbi.nlm.nih.gov/pubmed/19716946?tool=bestpractice.com[122]Kew KM, Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014 Mar 10;(3):CD010115.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010115.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/24615270?tool=bestpractice.com 接受 ICS 治疗的 COPD 成人患者中,结核病和流感风险的升高也引发了关注,但一项荟萃分析发现,所有经评估的结核病病例中,仅不到 1% 的病例可归因于 ICS 暴露。[123]Dong YH, Chang CH, Lin Wu FL, et al. Use of inhaled corticosteroids in patients with COPD and the risk of TB and influenza: a systematic review and meta-analysis of randomized controlled trials. Chest. 2014 Jun;145(6):1286-97.http://www.ncbi.nlm.nih.gov/pubmed/24504044?tool=bestpractice.com[124]Castellana G, Castellana M, Castellana C, et al. Inhaled corticosteroids and risk of tuberculosis in patients with obstructive lung diseases: a systematic review and meta-analysis of non-randomized studies. Int J Chron Obstruct Pulmon Dis. 2019 Sep 26;14:2219-27.https://www.dovepress.com/inhaled-corticosteroids-and-risk-of-tuberculosis-in-patients-with-obst-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/31576118?tool=bestpractice.com ICS 也可能引起口咽念珠菌病病和声音嘶哑。[79]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com [  ]What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/full展示答案
]What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/full展示答案
尽管有报道称,ICS 的使用将使肺癌罹患风险要么升高,要么降低,但现有数据似乎并不支持任一结论;尚需进行进一步研究。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
临床医生应权衡开处 ICS 的潜在益处和风险,并与患者进行讨论。[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].https://www.nice.org.uk/guidance/ng115 有 COPD 加重住院史,尽管给予长效支气管舒张剂规律用药,仍出现每年两次或两次以上中度加重,血嗜酸性粒细胞 ≥300 个细胞/μL,和/或既往罹患哮喘或伴发哮喘,均强烈支持起始 ICS 治疗。[125]Agusti A, Fabbri LM, Singh D, et al. Inhaled corticosteroids in COPD: friend or foe? Eur Respir J. 2018 Dec 13;52(6):1801219.https://erj.ersjournals.com/content/52/6/1801219http://www.ncbi.nlm.nih.gov/pubmed/30190269?tool=bestpractice.com 肺炎反复发作、血嗜酸性粒细胞 <100 个细胞/μL,和/或具有分枝杆菌感染病史,均为 ICS 给药不支持因素。[125]Agusti A, Fabbri LM, Singh D, et al. Inhaled corticosteroids in COPD: friend or foe? Eur Respir J. 2018 Dec 13;52(6):1801219.https://erj.ersjournals.com/content/52/6/1801219http://www.ncbi.nlm.nih.gov/pubmed/30190269?tool=bestpractice.com 对于经过长效支气管舒张剂规律治疗,COPD 却仍每年出现一次中度加重,和/或外周血嗜酸性粒细胞水平为 100-300 个细胞/μL 的患者,可考虑使用 ICS 治疗。[125]Agusti A, Fabbri LM, Singh D, et al. Inhaled corticosteroids in COPD: friend or foe? Eur Respir J. 2018 Dec 13;52(6):1801219.https://erj.ersjournals.com/content/52/6/1801219http://www.ncbi.nlm.nih.gov/pubmed/30190269?tool=bestpractice.com
欧洲呼吸学会制定了 COPD 患者停用吸入皮质类固醇的指南。[126]Chalmers JD, Laska IF, Franssen FME, et al. Withdrawal of inhaled corticosteroids in COPD: a European Respiratory Society guideline. Eur Respir J. 2020 Jun 4;55(6):2000351.https://erj.ersjournals.com/content/55/6/2000351http://www.ncbi.nlm.nih.gov/pubmed/32366483?tool=bestpractice.com
不建议对 COPD 患者长期使用口服皮质类固醇。[90]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.https://www.atsjournals.org/doi/10.1164/rccm.202003-0625SThttp://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com 部分重症患者因急性加重起始口服皮质类固醇后,无法完全停止治疗。对于此类情况,剂量应保持尽可能低,并考虑给予骨质疏松预防性治疗。[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].https://www.nice.org.uk/guidance/ng115
支气管扩张剂和皮质类固醇联合制剂
同时需要长效支气管扩张剂和 ICS 治疗的患者可使用这两种药物的联合制剂。 [  ]What are the effects of long‐acting inhaled therapies for adults with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2364/full展示答案 联合制剂应用方便,同时可能改善部分患者的依从性。这类药物治疗的选择取决于药物的可及性、个人反应和患者偏好。[127]Tricco AC, Strifler L, Veroniki AA, et al. Comparative safety and effectiveness of long-acting inhaled agents for treating chronic obstructive pulmonary disease: a systematic review and network meta-analysis. BMJ Open. 2015 Oct 26;5(10):e009183. [Erratum in: BMJ Open. 2019 May 1;9(4):e009183corr1.]https://bmjopen.bmj.com/content/5/10/e009183.longhttp://www.ncbi.nlm.nih.gov/pubmed/26503392?tool=bestpractice.com 联合制剂可能由单独或联合吸入装置提供。
]What are the effects of long‐acting inhaled therapies for adults with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2364/full展示答案 联合制剂应用方便,同时可能改善部分患者的依从性。这类药物治疗的选择取决于药物的可及性、个人反应和患者偏好。[127]Tricco AC, Strifler L, Veroniki AA, et al. Comparative safety and effectiveness of long-acting inhaled agents for treating chronic obstructive pulmonary disease: a systematic review and network meta-analysis. BMJ Open. 2015 Oct 26;5(10):e009183. [Erratum in: BMJ Open. 2019 May 1;9(4):e009183corr1.]https://bmjopen.bmj.com/content/5/10/e009183.longhttp://www.ncbi.nlm.nih.gov/pubmed/26503392?tool=bestpractice.com 联合制剂可能由单独或联合吸入装置提供。
多项研究认为,在中度至重度 COPD 加重率和住院率方面,LABA/LAMA/ICS 三联疗法优于单药治疗或者 LABA/LAMA 或 LABA/ICS 二联疗法。[74]Cazzola M, Rogliani P, Calzetta L, et al. Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir J. 2018 Dec 13;52(6):1801586.https://erj.ersjournals.com/content/52/6/1801586http://www.ncbi.nlm.nih.gov/pubmed/30309975?tool=bestpractice.com[82]Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting beta2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet. 2016 Sep 3;388(10048):963-73.http://www.ncbi.nlm.nih.gov/pubmed/27598678?tool=bestpractice.com[83]Vestbo J, Papi A, Corradi M, et al. Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a double-blind, parallel group, randomised controlled trial. Lancet. 2017 May 13;389(10082):1919-29.http://www.ncbi.nlm.nih.gov/pubmed/28385353?tool=bestpractice.com[84]Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018 Mar 17;391(10125):1076-84.http://www.ncbi.nlm.nih.gov/pubmed/29429593?tool=bestpractice.com[85]Lipson DA, Barnacle H, Birk R, et al. FULFIL Trial: once-daily triple therapy for patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2017 Aug 15;196(4):438-46.https://www.atsjournals.org/doi/full/10.1164/rccm.201703-0449OChttp://www.ncbi.nlm.nih.gov/pubmed/28375647?tool=bestpractice.com[86]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.https://www.nejm.org/doi/10.1056/NEJMoa1713901http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com[87]Rojas-Reyes MX, García Morales OM, Dennis RJ, et al. Combination inhaled steroid and long-acting beta₂-agonist in addition to tiotropium versus tiotropium or combination alone for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Jun 6;(6):CD008532.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD008532.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27271056?tool=bestpractice.com[88]Lai CC, Chen CH, Lin CYH, et al. The effects of single inhaler triple therapy vs single inhaler dual therapy or separate triple therapy for the management of chronic obstructive pulmonary disease: a systematic review and meta-analysis of randomized controlled trials. Int J Chron Obstruct Pulmon Dis. 2019 Jul 11;14:1539-48. [Erratum in: Int J Chron Obstruct Pulmon Dis. 2020 Jan 21;15:155-6.]https://www.dovepress.com/the-effects-of-single-inhaler-triple-therapy-vs-single-inhaler-dual-th-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/31371939?tool=bestpractice.com[89]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com 对于血嗜酸性粒细胞增多的轻至中度 COPD 患者,使用 ICS 还可减缓急性加重后肺功能减退的速度。[128]Kerkhof M, Voorham J, Dorinsky P, et al. Association between COPD exacerbations and lung function decline during maintenance therapy. Thorax. 2020 Sep;75(9):744-53.https://thorax.bmj.com/content/75/9/744http://www.ncbi.nlm.nih.gov/pubmed/32532852?tool=bestpractice.com 一项随机对照试验报告称,对于 FEV₁<50% 且过去一年至少出现过一次急性加重的患者,相比使用乌美溴铵/维兰特罗,使用糠酸氟替卡松/乌美溴铵/维兰特罗者的全因死亡率降低。对于过去一年至少出现过两次中度加重或一次重度加重的轻度 COPD 患者,相比使用乌美溴铵/维兰特罗,使用糠酸氟替卡松/乌美溴铵/维兰特罗者的全因死亡率也有所降低。[129]Lipson DA, Crim C, Criner GJ, et al. Reduction in all-cause mortality with fluticasone furoate/umeclidinium/vilanterol in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2020 Jun 15;201(12):1508-16.https://www.atsjournals.org/doi/10.1164/rccm.201911-2207OChttp://www.ncbi.nlm.nih.gov/pubmed/32162970?tool=bestpractice.com 另一项随机对照试验中,对于三联治疗组(布地奈德/格隆溴铵/福莫特罗)死亡率而言,具有相似发现,但仅在 ICS 剂量较高时。[89]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com[130]Martinez FJ, Rabe KF, Ferguson GT, et al. Reduced all-cause mortality in the ETHOS trial of budesonide/glycopyrrolate/formoterol for chronic obstructive pulmonary disease. A randomized, double-blind, multicenter, parallel-group study. Am J Respir Crit Care Med. 2021 Mar 1;203(5):553-64.https://www.atsjournals.org/doi/10.1164/rccm.202006-2618OChttp://www.ncbi.nlm.nih.gov/pubmed/33252985?tool=bestpractice.com 同一研究表明,与使用标准剂量的三联疗法相比,在三联疗法中增加布地奈德剂量并未降低急性加重率。[89]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com 两项研究与 LABA/ICS 治疗相比,死亡率无差异。[89]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com[129]Lipson DA, Crim C, Criner GJ, et al. Reduction in all-cause mortality with fluticasone furoate/umeclidinium/vilanterol in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2020 Jun 15;201(12):1508-16.https://www.atsjournals.org/doi/10.1164/rccm.201911-2207OChttp://www.ncbi.nlm.nih.gov/pubmed/32162970?tool=bestpractice.com[130]Martinez FJ, Rabe KF, Ferguson GT, et al. Reduced all-cause mortality in the ETHOS trial of budesonide/glycopyrrolate/formoterol for chronic obstructive pulmonary disease. A randomized, double-blind, multicenter, parallel-group study. Am J Respir Crit Care Med. 2021 Mar 1;203(5):553-64.https://www.atsjournals.org/doi/10.1164/rccm.202006-2618OChttp://www.ncbi.nlm.nih.gov/pubmed/33252985?tool=bestpractice.com 一项包含 3 项临床试验(关于有重度气道受限和急性加重史的 COPD 患者采取三联疗法)的事后分析发现, 与非 ICS 治疗相比,三联疗法降低死亡率的趋势并不明显。[131]Vestbo J, Fabbri L, Papi A, et al. Inhaled corticosteroid containing combinations and mortality in COPD. Eur Respir J. 2018 Dec 13;52(6):1801230.https://erj.ersjournals.com/content/52/6/1801230http://www.ncbi.nlm.nih.gov/pubmed/30209195?tool=bestpractice.com 对 200 多项研究进行的荟萃分析证实了这些结果:与二联治疗相比,三联治疗显著降低了死亡率,但与肺炎风险升高具有相关性。在肺功能或健康相关性生活质量方面,未观察到不同给药方案之间具有差异。[132]Axson EL, Lewis A, Potts J, et al. Inhaled therapies for chronic obstructive pulmonary disease: a systematic review and meta-analysis. BMJ Open. 2020 Sep 29;10(9):e036455.https://bmjopen.bmj.com/content/10/9/e036455http://www.ncbi.nlm.nih.gov/pubmed/32994234?tool=bestpractice.com
在开具三联疗法处方之前,临床医师应评估患者的症状是否可能由其他身体或精神疾病引起。英国指南建议临床医师在 3 个月后对采用三联疗法缓解日常症状的患者进行复查。如果患者的症状未得到改善,应将治疗换为 LABA/LAMA。[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].https://www.nice.org.uk/guidance/ng115 如果患者在过去一年中未发生加重,则可以停用 ICS。[90]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.https://www.atsjournals.org/doi/10.1164/rccm.202003-0625SThttp://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com 一项对来自真实世界研究数据的系统评价发现,中重度 COPD 患者停用 ICS,并随后给予适当的药物治疗时,几乎没有证据表明呈现更劣的结局。[133]Rogliani P, Ritondo BL, Gabriele M, et al. Optimizing de-escalation of inhaled corticosteroids in COPD: a systematic review of real-world findings. Expert Rev Clin Pharmacol. 2020 Sep;13(9):977-90.https://www.tandfonline.com/doi/full/10.1080/17512433.2020.1817739http://www.ncbi.nlm.nih.gov/pubmed/32885691?tool=bestpractice.com
磷酸二酯酶-4 抑制剂
罗氟司特是一种口服磷酸二酯酶-4 抑制剂,可抑制 cAMP 分解。可考虑用于正在使用 LABA/LAMA/ICS 的 FEV₁ <50% 预测值且有慢性支气管炎的患者,尤其是如果此类患者在过去一年有至少一次因急性加重而住院治疗。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ roflumilast 可改善肺功能,并降低加重的可能性。然而,它对生活质量或症状几乎没有改善作用。[134]Janjua S, Fortescue R, Poole P. Phosphodiesterase-4 inhibitors for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2020 May 1;(5):CD002309.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002309.pub6/fullhttp://www.ncbi.nlm.nih.gov/pubmed/32356609?tool=bestpractice.com [  ]How do phosphodiesterase‐4 inhibitors compare with placebo for people with chronic obstructive pulmonary disease?https://www.cochranelibrary.com/cca/doi/10.1002/cca.3151/full展示答案
]How do phosphodiesterase‐4 inhibitors compare with placebo for people with chronic obstructive pulmonary disease?https://www.cochranelibrary.com/cca/doi/10.1002/cca.3151/full展示答案
抗生素
为了降低急性加重的风险,可考虑使用预防性抗生素(例如大环内酯类),对于频繁加重且标准治疗效果不佳的患者,尤其应该这样做。[135]Simoens S, Laekeman G, Decramer M. Preventing COPD exacerbations with macrolides: a review and budget impact analysis. Respir Med. 2013 May;107(5):637-48.http://www.ncbi.nlm.nih.gov/pubmed/23352223?tool=bestpractice.com[136]Lee JS, Park DA, Hong Y, et al. Systematic review and meta-analysis of prophylactic antibiotics in COPD and/or chronic bronchitis. Int J Tuberc Lung Dis. 2013 Feb;17(2):153-62.http://www.ncbi.nlm.nih.gov/pubmed/23317949?tool=bestpractice.com[137]Uzun S, Djamin RS, Kluytmans JA, et al. Azithromycin maintenance treatment in patients with frequent exacerbations of chronic obstructive pulmonary disease (COLUMBUS): a randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2014 May;2(5):361-8.http://www.ncbi.nlm.nih.gov/pubmed/24746000?tool=bestpractice.com[138]Janjua S, Mathioudakis AG, Fortescue R, et al. Prophylactic antibiotics for adults with chronic obstructive pulmonary disease: a network meta-analysis. Cochrane Database Syst Rev. 2021 Jan 15;(1):CD013198.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013198.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/33448349?tool=bestpractice.com 一项 Cochrane 评价将大环内酯类药物列为减少急性加重和严重不良事件以及改善生存质量的首选药物,优于氟喹诺酮类和四环素类药物。[138]Janjua S, Mathioudakis AG, Fortescue R, et al. Prophylactic antibiotics for adults with chronic obstructive pulmonary disease: a network meta-analysis. Cochrane Database Syst Rev. 2021 Jan 15;(1):CD013198.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013198.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/33448349?tool=bestpractice.com 预防性使用大环内酯类抗生素可降低 COPD 患者加重的频率,但长期使用阿奇霉素与具有临床意义的听力丧失有关,这在多数情况下具有可逆性。[139]Herath SC, Normansell R, Maisey S, et al. Prophylactic antibiotic therapy for chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev. 2018 Oct 30;(10):CD009764.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009764.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/30376188?tool=bestpractice.com [  ]What are the effects of prophylactic antibiotics for people with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2431/full展示答案 目前尚无数据显示长期使用阿奇霉素治疗超过 1 年的有效性或安全性。
]What are the effects of prophylactic antibiotics for people with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2431/full展示答案 目前尚无数据显示长期使用阿奇霉素治疗超过 1 年的有效性或安全性。
在预防急性加重方面,通常认为阿奇霉素治疗最有效,对于老年患者和 GOLD 分级较低的患者,这方面的有效性更为显著。关于对当前吸烟者的治疗获益,几乎没有证据。[140]Han MK, Tayob N, Murray S, et al. Predictors of chronic obstructive pulmonary disease exacerbation reduction in response to daily azithromycin therapy. Am J Respir Crit Care Med. 2014 Jun 15;189(12):1503-8.https://www.atsjournals.org/doi/full/10.1164/rccm.201402-0207OC#.V9weczUpW9Yhttp://www.ncbi.nlm.nih.gov/pubmed/24779680?tool=bestpractice.com 阿奇霉素会增加大环内酯类抗生素耐药性微生物的定植风险,因此不应对有听力障碍、静息心动过速或明显 QTc 延长风险的患者开处此药。[141]Albert RK, Connett J, Bailey WC, et al; COPD Clinical Research Network. Azithromycin for prevention of exacerbations of COPD. N Engl J Med. 2011 Aug 25;365(8):689-98.https://www.nejm.org/doi/full/10.1056/NEJMoa1104623http://www.ncbi.nlm.nih.gov/pubmed/21864166?tool=bestpractice.com 对于已接受适当治疗但仍持续加重的既往曾吸烟患者,应考虑优先使用阿奇霉素,但不仅限于此类患者)。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
英国指南建议,如果患者一年中出现过三次以上需要皮质类固醇治疗的急性加重,或至少一次需要住院治疗的加重,可以考虑预防性使用阿奇霉素。[142]Smith D, Du Rand I, Addy CL, et al. British Thoracic Society guideline for the use of long-term macrolides in adults with respiratory disease. Thorax. 2020 May;75(5):370-404.https://thorax.bmj.com/content/75/5/370http://www.ncbi.nlm.nih.gov/pubmed/32303621?tool=bestpractice.com 在开始预防性使用抗生素之前,应检查基线 ECG 和肝功能,采集痰液标本进行培养和药敏性试验(包括结核病检查),应优化患者的排痰方法,并通过 CT 扫描排除支气管扩张。[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].https://www.nice.org.uk/guidance/ng115[142]Smith D, Du Rand I, Addy CL, et al. British Thoracic Society guideline for the use of long-term macrolides in adults with respiratory disease. Thorax. 2020 May;75(5):370-404.https://thorax.bmj.com/content/75/5/370http://www.ncbi.nlm.nih.gov/pubmed/32303621?tool=bestpractice.com 治疗 1 个月后应再次进行 ECG 和肝脏检查。一项关于使用氟喹诺酮类、四环素类和大环内酯类抗生素对 COPD 患者治疗 12-13 周的头对头比较性研究发现,这几类抗生素的有效性或安全性无差异,但纳入研究的样本量小且研究时间短;因此,在该方面还需要进一步研究。[143]Threapleton CJ, Janjua S, Fortescue R, et al. Head-to-head oral prophylactic antibiotic therapy for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 May 24;(5):CD013024.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013024.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/31125127?tool=bestpractice.com
应在 6 个月和 12 个月时评估预防性抗生素治疗,以确定对加重发生率是否有益。[142]Smith D, Du Rand I, Addy CL, et al. British Thoracic Society guideline for the use of long-term macrolides in adults with respiratory disease. Thorax. 2020 May;75(5):370-404.https://thorax.bmj.com/content/75/5/370http://www.ncbi.nlm.nih.gov/pubmed/32303621?tool=bestpractice.com 如果抗生素治疗无效,应停止使用。
甲基黄嘌呤
茶碱(一种甲基黄嘌呤类药物)是一种支气管舒张剂,通过增加 cAMP,然后松弛呼吸平滑肌发挥作用。由于这类药物作用有限、治疗窗窄、风险高、与其他药物有频繁的相互作用,因此较少使用。茶碱对中至重度 COPD 患者的肺功能有轻微作用。[144]Ram FSF, Jones P, Jardim J, et al. Oral theophylline for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2002;(4):CD003902.http://www.ncbi.nlm.nih.gov/pubmed/12519617?tool=bestpractice.com 一项大型随机对照试验发现,单纯口服茶碱,或联合使用泼尼松龙,对于重度 COPD 急性加重无治疗效果。[145]Jenkins CR, Wen FQ, Martin A, et al; TASCS study investigators. The effect of low-dose corticosteroids and theophylline on the risk of acute exacerbations of COPD: the TASCS randomised controlled trial. Eur Respir J. 2021 Jun 10;57(6):2003338.https://erj.ersjournals.com/content/57/6/2003338http://www.ncbi.nlm.nih.gov/pubmed/33334939?tool=bestpractice.com 如果所有吸入治疗选择均无效,专家可能开具茶碱。但除非没有或负担不起其他长效支气管舒张剂,否则不建议使用茶碱。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
患者教育和自我管理
对所有患者进行关于疾病病程、急性加重或失代偿时症状方面的教育。他们对疾病的预期、治疗和预后不应过于乐观。重要的是记住目前没有药物可以修复长期下降的肺功能,药物治疗的主要目标是控制症状和预防并发症。
一项 Cochrane 评价发现,若自我管理干预措施中纳入针对 COPD 急性加重的行动计划,则其可改善卫生健康相关的生活质量并减少由呼吸问题所致的入院次数。一项探索性分析发现,相比常规治疗,采用自我管理措施引起了患者呼吸相关死亡率统计学上的显著升高(尽管死亡率不高),但并未发现全因死亡率具有超额危险度[146]Lenferink A, Brusse-Keizer M, van der Valk PD, et al. Self-management interventions including action plans for exacerbations versus usual care in patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Aug 4;(8):CD011682.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011682.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/28777450?tool=bestpractice.com 一项随机对照试验表明,对于近期出院的 COPD 加重患者,起始为期 3 个月的自我管理计划,可致 COPD 相关性住院增加,6 个月内急诊就诊人次亦增加。[147]Aboumatar H, Naqibuddin M, Chung S, et al. Effect of a hospital-initiated program combining transitional care and long-term self-management support on outcomes of patients hospitalized with chronic obstructive pulmonary disease: a randomized clinical trial. JAMA. 2019 Oct 8;322(14):1371-80.https://jamanetwork.com/journals/jama/fullarticle/2752467http://www.ncbi.nlm.nih.gov/pubmed/31593271?tool=bestpractice.com
自我管理计划应包含以下各方面的个性化建议:呼吸困难和应激管理技巧,保存能量,避免恶化因素,如何监测症状,如何应对恶化的症状,以及在发生急性加重时的联系信息。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
理想情况下,帮助患者进行自我管理应能解决社会心理问题,以及患者对 COPD 及其管理的个人看法。许多患者报告在诊断为 COPD 后,出现生活方式和社交方面困扰并受到限制。据估计,COPD 患者的自杀死亡可能性是非 COPD 患者的 1.9 倍,焦虑、抑郁和沮丧症状十分常见。[148]Sampaio MS, Vieira WA, Bernardino ÍM, et al. Chronic obstructive pulmonary disease as a risk factor for suicide: a systematic review and meta-analysis. Respir Med. 2019 May;151:11-18.https://www.resmedjournal.com/article/S0954-6111(19)30093-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/31047105?tool=bestpractice.com[149]Russell S, Ogunbayo OJ, Newham JJ, et al. Qualitative systematic review of barriers and facilitators to self-management of chronic obstructive pulmonary disease: views of patients and healthcare professionals. NPJ Prim Care Respir Med. 2018 Jan 17;28(1):2.https://www.nature.com/articles/s41533-017-0069-zhttp://www.ncbi.nlm.nih.gov/pubmed/29343739?tool=bestpractice.com研究发现,认知行为治疗(behavioural therapy, CBT)有益于抑郁和焦虑症状、生活质量和急诊就诊频率等结局。[150]Pollok J, van Agteren JE, Esterman AJ, et al. Psychological therapies for the treatment of depression in chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 Mar 6;(3):CD012347.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012347.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/30838649?tool=bestpractice.com[151]Ma RC, Yin YY, Wang YQ, et al. Effectiveness of cognitive behavioural therapy for chronic obstructive pulmonary disease patients: a systematic review and meta-analysis. Complement Ther Clin Pract. 2020 Feb;38:101071.http://www.ncbi.nlm.nih.gov/pubmed/31743870?tool=bestpractice.com[152]Williams MT, Johnston KN, Paquet C. Cognitive behavioral therapy for people with chronic obstructive pulmonary disease: rapid review. Int J Chron Obstruct Pulmon Dis. 2020 Apr 23;15:903-19.https://www.dovepress.com/cognitive-behavioral-therapy-for-people-with-chronic-obstructive-pulmo-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/32425516?tool=bestpractice.com 需对资源密集型与资源有限型 CBT 的效果进行进一步研究。[152]Williams MT, Johnston KN, Paquet C. Cognitive behavioral therapy for people with chronic obstructive pulmonary disease: rapid review. Int J Chron Obstruct Pulmon Dis. 2020 Apr 23;15:903-19.https://www.dovepress.com/cognitive-behavioral-therapy-for-people-with-chronic-obstructive-pulmo-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/32425516?tool=bestpractice.com
一项随机对照临床试验发现,在初级医疗卫生中,旨在促进轻度 COPD 患者行为改变的电话健康指导干预可改善患者的自我管理活动,但并未改善与卫生健康相关的生活质量。[153]Jolly K, Sidhu MS, Hewitt CA, et al. Self management of patients with mild COPD in primary care: randomised controlled trial. BMJ. 2018 Jun 13;361:k2241.https://www.bmj.com/content/361/bmj.k2241.longhttp://www.ncbi.nlm.nih.gov/pubmed/29899047?tool=bestpractice.com 一项 meta 分析发现,包括目标设定、动机性访谈以及与 COPD 相关健康教育在内的健康指导能显著改善与健康相关的生活质量,并减少因 COPD 加重而入院的次数,但并未减少全因入院次数。[154]Long H, Howells K, Peters S, et al. Does health coaching improve health-related quality of life and reduce hospital admissions in people with chronic obstructive pulmonary disease? A systematic review and meta-analysis. Br J Health Psychol. 2019 Sep;24(3):515-46.https://bpspsychub.onlinelibrary.wiley.com/doi/10.1111/bjhp.12366http://www.ncbi.nlm.nih.gov/pubmed/31033121?tool=bestpractice.com
使用吸入治疗的患者应接受吸入器装置使用方法培训。多数患者在使用吸入器时至少犯一次错误,并且错误使用吸入器与疾病控制能力下降有关。[155]Cho-Reyes S, Celli BR, Dembek C, et al. Inhalation technique errors with metered-dose inhalers among patients with obstructive lung diseases: a systematic review and meta-analysis of US Studies. Chronic Obstr Pulm Dis. 2019 Jul 24;6(3):267-80.https://journal.copdfoundation.org/jcopdf/id/1241/Inhalation-Technique-Errors-with-Metered-Dose-Inhalers-Among-Patients-with-Obstructive-Lung-Diseases-A-Systematic-Review-and-Meta-Analysis-of-US-Studieshttp://www.ncbi.nlm.nih.gov/pubmed/31342732?tool=bestpractice.com[156]Melani AS, Bonavia M, Cilenti V, et al. Inhaler mishandling remains common in real life and is associated with reduced disease control. Respir Med. 2011 Jun;105(6):930-8.https://www.resmedjournal.com/article/S0954-6111(11)00009-6/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/21367593?tool=bestpractice.com 当患者使用多种装置或从未接受过吸入器装置使用方法培训时,更可能使用不当。[157]Rootmensen GN, van Keimpema AR, Jansen HM, et al. Predictors of incorrect inhalation technique in patients with asthma or COPD: a study using a validated videotaped scoring method. J Aerosol Med Pulm Drug Deliv. 2010 Oct;23(5):323-8.http://www.ncbi.nlm.nih.gov/pubmed/20804428?tool=bestpractice.com 临床医生演示吸入器用法、选用合适的装置以及在后续复诊时检查使用方法均可改善吸入器使用技术。[158]Price D, Keininger DL, Viswanad B, et al. Factors associated with appropriate inhaler use in patients with COPD - lessons from the REAL survey. Int J Chron Obstruct Pulmon Dis. 2018 Feb 26;13:695-702. [Erratum in: Int J Chron Obstruct Pulmon Dis. 2018 Jul 25;13:2253-4.]https://www.dovepress.com/factors-associated-with-appropriate-inhaler-use-in-patients-with-copd--peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/29520137?tool=bestpractice.com 对于 ≥65 岁的成人,使用安慰剂装置示范对教授吸入器使用方法可能最有效。[159]Maricoto T, Monteiro L, Gama JMR, et al. Inhaler technique education and exacerbation risk in older adults with asthma or chronic obstructive pulmonary disease: a meta-analysis. J Am Geriatr Soc. 2019 Jan;67(1):57-66.http://www.ncbi.nlm.nih.gov/pubmed/30291745?tool=bestpractice.com 应让患者将吸入器带到门诊,以便检查吸入器的使用情况。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 药师主导的干预和非专业健康指导可改善 COPD 患者吸入器使用技术和依从性。[160]Jia X, Zhou S, Luo D, et al. Effect of pharmacist-led interventions on medication adherence and inhalation technique in adult patients with asthma or COPD: a systematic review and meta-analysis. J Clin Pharm Ther. 2020 Oct;45(5):904-17.https://onlinelibrary.wiley.com/doi/10.1111/jcpt.13126http://www.ncbi.nlm.nih.gov/pubmed/32107837?tool=bestpractice.com[161]Willard-Grace R, Chirinos C, Wolf J, et al. Lay health coaching to increase appropriate inhaler use in COPD: a randomized controlled trial. Ann Fam Med. 2020 Jan;18(1):5-14.https://www.annfammed.org/content/18/1/5http://www.ncbi.nlm.nih.gov/pubmed/31937527?tool=bestpractice.com 吸入装置的优点(例如快速缓解症状以及小巧便携)已在患者偏好研究中有所体现。[162]Navaie M, Dembek C, Cho-Reyes S, et al. Inhaler device feature preferences among patients with obstructive lung diseases: a systematic review and meta-analysis. Medicine (Baltimore). 2020 Jun 19;99(25):e20718.https://journals.lww.com/md-journal/fulltext/2020/06190/inhaler_device_feature_preferences_among_patients.56.aspxhttp://www.ncbi.nlm.nih.gov/pubmed/32569208?tool=bestpractice.com[163]Tervonen T, Hawken N, Hanania NA, et al. Maintenance inhaler therapy preferences of patients with asthma or chronic obstructive pulmonary disease: a discrete choice experiment. Thorax. 2020 Sep;75(9):735-43.https://thorax.bmj.com/content/75/9/735http://www.ncbi.nlm.nih.gov/pubmed/32631932?tool=bestpractice.com
定量气雾剂 一位主管药剂师向患者展示如何使用定量吸入器,并讨论改善吸入器使用技术的方法。
定量吸入器加储雾罐 一位主管药剂师向患者展示如何使用定量吸入器加储雾罐,并讨论改善吸入器使用技术的方法。
干粉吸入剂 一位主管药剂师向患者展示如何使用干粉装置,并讨论改善吸入器使用技术的方法。
软雾吸入器 一位主管药剂师向患者展示如何使用软雾吸入器,并讨论改善吸入器使用技术的方法。
对于所有COPD患者推荐进行体育活动。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 对随机对照临床试验进行的一项系统评价和荟萃分析发现,运动训练本身可以改善 COPD 患者的身体活动,并且通过辅以体育活动咨询可进一步改善状况。[164]Lahham A, McDonald CF, Holland AE. Exercise training alone or with the addition of activity counseling improves physical activity levels in COPD: a systematic review and meta-analysis of randomized controlled trials. Int J Chron Obstruct Pulmon Dis. 2016 Dec 8;11:3121-36.https://www.dovepress.com/exercise-training-alone-or-with-the-addition-of-activity-counseling-im-peer-reviewed-fulltext-article-COPDhttp://www.ncbi.nlm.nih.gov/pubmed/27994451?tool=bestpractice.com 另一项系统评价和荟萃分析发现,在增加 6 分钟步行距离方面,将有氧运动和力量训练相结合比仅进行力量训练或耐力训练更有效。[165]Vooijs M, Siemonsma PC, Heus I, et al. Therapeutic validity and effectiveness of supervised physical exercise training on exercise capacity in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Clin Rehabil. 2016 Nov;30(11):1037-48.http://www.ncbi.nlm.nih.gov/pubmed/26451006?tool=bestpractice.com 其他研究表明,坚持有监督和无监督的锻炼计划后,峰值摄氧量、乏力感和健康相关性生活质量均有所改善。[166]Ward TJC, Plumptre CD, Dolmage TE, et al. Change in VO2peak in response to aerobic exercise training and the relationship with exercise prescription in people with COPD: a systematic review and meta-analysis. Chest. 2020 Jul;158(1):131-44.http://www.ncbi.nlm.nih.gov/pubmed/32173489?tool=bestpractice.com[167]Paneroni M, Vitacca M, Venturelli M, et al. The impact of exercise training on fatigue in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Pulmonology. 2020 Sep - Oct;26(5):304-13.http://www.ncbi.nlm.nih.gov/pubmed/32184070?tool=bestpractice.com[168]Taylor D, Jenkins AR, Parrott K, et al. Efficacy of unsupervised exercise in adults with obstructive lung disease: a systematic review and meta-analysis. Thorax. 2021 Jun;76(6):591-600.http://www.ncbi.nlm.nih.gov/pubmed/33685962?tool=bestpractice.com 一项 Cochrane 评价发现,通过体力活动咨询、运动训练和 COPD 药物治疗改善体力活动的证据有限。作者评论,由于缺少方法学细节,质量评估受到限制,并且各种干预措施主要是在单项研究中进行评估。[169]Burge AT, Cox NS, Abramson MJ, et al. Interventions for promoting physical activity in people with chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev. 2020 Apr 16;(4):CD012626.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012626.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/32297320?tool=bestpractice.com [  ]Which interventions lead to increased regular physical activity for people with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.3155/full展示答案 改善体力活动的最佳时机、因素、持续时间和模式尚不清楚。荟萃分析表明,瑜伽、气功和其他居家呼吸练习可改善 COPD 患者的运动能力和肺功能。[170]Cramer H, Haller H, Klose P, et al. The risks and benefits of yoga for patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Clin Rehabil. 2019 Dec;33(12):1847-62.http://www.ncbi.nlm.nih.gov/pubmed/31353959?tool=bestpractice.com[171]Tong H, Liu Y, Zhu Y, et al. The therapeutic effects of qigong in patients with chronic obstructive pulmonary disease in the stable stage: a meta-analysis. BMC Complement Altern Med. 2019 Sep 4;19(1):239.https://bmccomplementmedtherapies.biomedcentral.com/articles/10.1186/s12906-019-2639-9http://www.ncbi.nlm.nih.gov/pubmed/31484521?tool=bestpractice.com[172]Lu Y, Li P, Li N, et al. Effects of home-based breathing exercises in subjects with COPD. Respir Care. 2020 Mar;65(3):377-87.https://rc.rcjournal.com/content/65/3/377http://www.ncbi.nlm.nih.gov/pubmed/31719191?tool=bestpractice.com 研究显示,与常规治疗相比,太极拳可改善运动能力。[173]Liu X, Fu C, Hu W, et al. The effect of Tai Chi on the pulmonary rehabilitation of chronic obstructive pulmonary disease: a systematic review and meta-analysis. Ann Palliat Med. 2021 Apr;10(4):3763-82.https://apm.amegroups.org/article/view/67333/htmlhttp://www.ncbi.nlm.nih.gov/pubmed/33894710?tool=bestpractice.com
]Which interventions lead to increased regular physical activity for people with chronic obstructive pulmonary disease (COPD)?https://www.cochranelibrary.com/cca/doi/10.1002/cca.3155/full展示答案 改善体力活动的最佳时机、因素、持续时间和模式尚不清楚。荟萃分析表明,瑜伽、气功和其他居家呼吸练习可改善 COPD 患者的运动能力和肺功能。[170]Cramer H, Haller H, Klose P, et al. The risks and benefits of yoga for patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Clin Rehabil. 2019 Dec;33(12):1847-62.http://www.ncbi.nlm.nih.gov/pubmed/31353959?tool=bestpractice.com[171]Tong H, Liu Y, Zhu Y, et al. The therapeutic effects of qigong in patients with chronic obstructive pulmonary disease in the stable stage: a meta-analysis. BMC Complement Altern Med. 2019 Sep 4;19(1):239.https://bmccomplementmedtherapies.biomedcentral.com/articles/10.1186/s12906-019-2639-9http://www.ncbi.nlm.nih.gov/pubmed/31484521?tool=bestpractice.com[172]Lu Y, Li P, Li N, et al. Effects of home-based breathing exercises in subjects with COPD. Respir Care. 2020 Mar;65(3):377-87.https://rc.rcjournal.com/content/65/3/377http://www.ncbi.nlm.nih.gov/pubmed/31719191?tool=bestpractice.com 研究显示,与常规治疗相比,太极拳可改善运动能力。[173]Liu X, Fu C, Hu W, et al. The effect of Tai Chi on the pulmonary rehabilitation of chronic obstructive pulmonary disease: a systematic review and meta-analysis. Ann Palliat Med. 2021 Apr;10(4):3763-82.https://apm.amegroups.org/article/view/67333/htmlhttp://www.ncbi.nlm.nih.gov/pubmed/33894710?tool=bestpractice.com
已发现饮食建议和口服补剂可改善体重、生活质量、呼吸肌力量和 6 分钟步行距离。[174]Collins PF, Elia M, Stratton RJ. Nutritional support and functional capacity in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Respirology. 2013 May;18(4):616-29.https://onlinelibrary.wiley.com/doi/10.1111/resp.12070http://www.ncbi.nlm.nih.gov/pubmed/23432923?tool=bestpractice.com[175]Ferreira IM, Brooks D, White J, et al. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2012 Dec 12;(12):CD000998.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000998.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/23235577?tool=bestpractice.com 然而,营养支持并未一致发现对于肺功能有所改善。[175]Ferreira IM, Brooks D, White J, et al. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2012 Dec 12;(12):CD000998.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000998.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/23235577?tool=bestpractice.com
戒烟
应鼓励所有患者戒烟,并接受指导,避免职业或环境烟草烟雾暴露和其他刺激物暴露。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].https://www.nice.org.uk/guidance/ng115 戒烟能使 COPD 进展速度和肿瘤风险显著降低。戒烟还可以降低冠心病和脑血管病的风险。在 COPD 多种不同的治疗方式中,只有两个因素可以改善存活情况,即戒烟和氧疗。
通常的戒烟项目包括咨询、互助小组和药物治疗。[176]Gonzales D, Rennard SI, Nides M, et al; Varenicline Phase 3 Study Group. Varenicline, an alpha4beta2 nicotinic acetylcholine receptor partial agonist, vs sustained-release bupropion and placebo for smoking cessation: a randomized controlled trial. JAMA. 2006 Jul 5;296(1):47-55.https://jamanetwork.com/journals/jama/fullarticle/211000http://www.ncbi.nlm.nih.gov/pubmed/16820546?tool=bestpractice.com 一些患者可能需要多次转诊才能成功戒烟。通过药物治疗和高强度咨询等方式帮助患者戒烟,能够提高 COPD的治疗成功率,更具有成本效益,且每质量调整生命年的花费更低。[177]Hoogendoorn M, Feenstra TL, Hoogenveen RT, et al. Long-term effectiveness and cost-effectiveness of smoking cessation interventions in patients with COPD. Thorax. 2010 Aug;65(8):711-8.http://www.ncbi.nlm.nih.gov/pubmed/20685746?tool=bestpractice.com[178]Warnier MJ, van Riet EE, Rutten FH, et al. Smoking cessation strategies in patients with COPD. Eur Respir J. 2013 Mar;41(3):727-34.http://www.ncbi.nlm.nih.gov/pubmed/22936706?tool=bestpractice.com[179]van Eerd EA, van der Meer RM, van Schayck OC, et al. Smoking cessation for people with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Aug 20;(8):CD010744.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010744.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27545342?tool=bestpractice.com
使用电子烟和电子雾化产品等电子尼古丁传送系统(electronic nicotine delivery system, ENDS)作为戒烟的辅助手段存在争议。目前,观察性研究的证据并不支持使用 ENDS 来帮助 COPD 患者戒烟。[180]Bowler RP, Hansel NN, Jacobson S, et al; for COPDGene and SPIROMICS Investigators. Electronic cigarette use in US adults at risk for or with COPD: analysis from two observational cohorts. J Gen Intern Med. 2017 Dec;32(12):1315-22.https://link.springer.com/article/10.1007/s11606-017-4150-7http://www.ncbi.nlm.nih.gov/pubmed/28884423?tool=bestpractice.com 请参阅“戒烟(治疗路径)” 。
疫苗接种
根据本地指南,患者应接种流感病毒疫苗、肺炎链球菌疫苗、百日咳疫苗、水痘带状疱疹病毒疫苗、呼吸道合胞病毒疫苗和 2019 冠状病毒病(coronavirus disease 2019, COVID-19)疫苗。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[181]Centers for Disease Control and Prevention. Recommended vaccines for adults: lung disease (including asthma and COPD). Sep 2023 [internet publication].https://www.cdc.gov/vaccines/adults/rec-vac/health-conditions/lung-disease.html
流感疫苗接种可减少 COPD 加重。[182]Walters JA, Tang JN, Poole P, et al. Pneumococcal vaccines for preventing pneumonia in chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Jan 24;(1):CD001390.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001390.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/28116747?tool=bestpractice.com[183]Kopsaftis Z, Wood-Baker R, Poole P. Influenza vaccine for chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev. 2018 Jun 26;(6):CD002733.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002733.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/29943802?tool=bestpractice.com [  ]What are the effects of influenza vaccine in people with chronic obstructive pulmonary disease (COPD)?https://cochranelibrary.com/cca/doi/10.1002/cca.2235/full展示答案 美国疾病预防控制中心(Centers for Disease Control and Prevention, CDC)指南建议,对于既往未曾接受 PCV 或疫苗接种史未知的所有 COPD 患者,应接种单剂 15 价肺炎球菌结合疫苗(15-valent pneumococcal conjugate vaccine, PCV15)或 20 价 PCV(20-valent PCV, PCV20)。接种 PCV15 的患者应在至少一年后接种单剂 23 价多糖疫苗(23-valent polysaccharide vaccine, PPSV23)。[184]Centers for Disease Control and Prevention. Adult immunization schedule by age: recommendations for ages 19 years or older, United States, 2024. Nov 2023 [internet publication].https://www.cdc.gov/vaccines/schedules/hcp/imz/adult.html
]What are the effects of influenza vaccine in people with chronic obstructive pulmonary disease (COPD)?https://cochranelibrary.com/cca/doi/10.1002/cca.2235/full展示答案 美国疾病预防控制中心(Centers for Disease Control and Prevention, CDC)指南建议,对于既往未曾接受 PCV 或疫苗接种史未知的所有 COPD 患者,应接种单剂 15 价肺炎球菌结合疫苗(15-valent pneumococcal conjugate vaccine, PCV15)或 20 价 PCV(20-valent PCV, PCV20)。接种 PCV15 的患者应在至少一年后接种单剂 23 价多糖疫苗(23-valent polysaccharide vaccine, PPSV23)。[184]Centers for Disease Control and Prevention. Adult immunization schedule by age: recommendations for ages 19 years or older, United States, 2024. Nov 2023 [internet publication].https://www.cdc.gov/vaccines/schedules/hcp/imz/adult.html
CDC 建议年龄≥60 岁的 COPD 患者和/或慢性肺病或心脏病成人接种 RSV 疫苗。[185]Melgar M, Britton A, Roper LE, et al. Use of respiratory syncytial virus vaccines in older adults: recommendations of the Advisory Committee on Immunization Practices - United States, 2023. MMWR Morb Mortal Wkly Rep. 2023 Jul 21;72(29):793-801.https://www.cdc.gov/mmwr/volumes/72/wr/mm7229a4.htmhttp://www.ncbi.nlm.nih.gov/pubmed/37471262?tool=bestpractice.com CDC 还建议在青春期未接种破伤风/白喉/百日咳疫苗的 COPD 患者补种。[181]Centers for Disease Control and Prevention. Recommended vaccines for adults: lung disease (including asthma and COPD). Sep 2023 [internet publication].https://www.cdc.gov/vaccines/adults/rec-vac/health-conditions/lung-disease.html
黏液溶解剂
COPD慢性支气管炎亚型的患者通常频繁出现浓痰。黏液溶解剂不增加不良反应,在COPD急性加重期间可能有效。 [  ]For people with chronic bronchitis or chronic obstructive pulmonary disease, how do mucolytic agents compare with placebo?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2591/full展示答案 它们可以使急性加重频率和每月出现失能的天数略微减少,但不能改善肺功能和生活质量。[186]Poole P, Sathananthan K, Fortescue R. Mucolytic agents versus placebo for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 May 20;(5):CD001287.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001287.pub6/fullhttp://www.ncbi.nlm.nih.gov/pubmed/31107966?tool=bestpractice.com 一项 meta 分析对厄多司坦、羧甲司坦和乙酰半胱氨酸进行了比较,得出的结论为,厄多司坦的安全性和有效性最好。厄多司坦降低了因急性加重而住院的风险,它和乙酰半胱氨酸都缩短了急性加重的持续时间。[187]Rogliani P, Matera MG, Page C, et al. Efficacy and safety profile of mucolytic/antioxidant agents in chronic obstructive pulmonary disease: a comparative analysis across erdosteine, carbocysteine, and N-acetylcysteine. Respir Res. 2019 May 27;20(1):104.https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1078-yhttp://www.ncbi.nlm.nih.gov/pubmed/31133026?tool=bestpractice.com 另一项荟萃分析发现,与安慰剂相比,乙酰半胱氨酸可显著降低急性加重发病率,而不良反应风险未见升高。作者得出结论,3 个月低剂量治疗具有疗效。[188]Wei J, Pang CS, Han J, et al. Effect of orally administered N-acetylcysteine on chronic bronchitis: a meta-analysis. Adv Ther. 2019 Dec;36(12):3356-67.http://www.ncbi.nlm.nih.gov/pubmed/31598901?tool=bestpractice.com 厄多司坦和羧甲司坦在美国和部分其他国家尚无法使用。使用化痰药物(例如羧甲司坦和乙酰半胱氨酸)进行治疗,可减少未接受 ICS 的患者发生急性加重,并适度改善健康状况。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 但是,无论患者是否正在使用 ICS,厄多司坦对于轻度加重具有显著效果。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
]For people with chronic bronchitis or chronic obstructive pulmonary disease, how do mucolytic agents compare with placebo?https://www.cochranelibrary.com/cca/doi/10.1002/cca.2591/full展示答案 它们可以使急性加重频率和每月出现失能的天数略微减少,但不能改善肺功能和生活质量。[186]Poole P, Sathananthan K, Fortescue R. Mucolytic agents versus placebo for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 May 20;(5):CD001287.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001287.pub6/fullhttp://www.ncbi.nlm.nih.gov/pubmed/31107966?tool=bestpractice.com 一项 meta 分析对厄多司坦、羧甲司坦和乙酰半胱氨酸进行了比较,得出的结论为,厄多司坦的安全性和有效性最好。厄多司坦降低了因急性加重而住院的风险,它和乙酰半胱氨酸都缩短了急性加重的持续时间。[187]Rogliani P, Matera MG, Page C, et al. Efficacy and safety profile of mucolytic/antioxidant agents in chronic obstructive pulmonary disease: a comparative analysis across erdosteine, carbocysteine, and N-acetylcysteine. Respir Res. 2019 May 27;20(1):104.https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1078-yhttp://www.ncbi.nlm.nih.gov/pubmed/31133026?tool=bestpractice.com 另一项荟萃分析发现,与安慰剂相比,乙酰半胱氨酸可显著降低急性加重发病率,而不良反应风险未见升高。作者得出结论,3 个月低剂量治疗具有疗效。[188]Wei J, Pang CS, Han J, et al. Effect of orally administered N-acetylcysteine on chronic bronchitis: a meta-analysis. Adv Ther. 2019 Dec;36(12):3356-67.http://www.ncbi.nlm.nih.gov/pubmed/31598901?tool=bestpractice.com 厄多司坦和羧甲司坦在美国和部分其他国家尚无法使用。使用化痰药物(例如羧甲司坦和乙酰半胱氨酸)进行治疗,可减少未接受 ICS 的患者发生急性加重,并适度改善健康状况。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 但是,无论患者是否正在使用 ICS,厄多司坦对于轻度加重具有显著效果。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
肺康复
肺康复项目包括有氧运动、力量训练和宣教。对于接受支气管舒张剂治疗后仍有症状的患者,应启动肺康复项目,且建议在病程早期(患者日常活动或平地行走出现呼吸急促时)开始。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[189]Rochester CL, Alison JA, Carlin B, et al. Pulmonary rehabilitation for adults with chronic respiratory disease: an official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2023 Aug 15;208(4):e7-26.https://www.atsjournals.org/doi/10.1164/rccm.202306-1066SThttp://www.ncbi.nlm.nih.gov/pubmed/37581410?tool=bestpractice.com[190]Man W, Chaplin E, Daynes E, et al. British Thoracic Society Clinical Statement on pulmonary rehabilitation. Thorax. 2023 Oct;78(suppl 5):s2-15.https://thorax.bmj.com/content/78/Suppl_5/s2http://www.ncbi.nlm.nih.gov/pubmed/37770084?tool=bestpractice.com GOLD 指南建议症状负担高且有急性加重风险的患者(即 B 组和 E 组)进行肺康复治疗。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
肺康复训练可缓解呼吸困难和疲劳、改善情绪功能,并能在较大程度增强控制感,将其改善到具有临床意义的程度。[191]McCarthy B, Casey D, Devane D, et al. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2015 Feb 23;(2):CD003793.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003793.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/25705944?tool=bestpractice.com 在因 COPD 急性加重入院治疗后进行综合性肺康复项目可降低再次入院的风险、改善健康相关的生存质量,并降低死亡率。 [  ]What are the effects of pulmonary rehabilitation after exacerbation in people with chronic obstructive pulmonary disease?https://cochranelibrary.com/cca/doi/10.1002/cca.1650/full展示答案 有证据支持在急性加重 1 个月内开始肺康复。[192]Marciniuk DD, Brooks D, Butcher S, et al. Canadian Thoracic Society COPD Committee Expert Working Group. Optimizing pulmonary rehabilitation in chronic obstructive pulmonary disease - practical issues: a Canadian Thoracic Society Clinical Practice Guideline. Can Respir J. 2010 Jul-Aug;17(4):159-68.http://www.ncbi.nlm.nih.gov/pubmed/20808973?tool=bestpractice.com[193]Puhan MA, Gimeno-Santos E, Cates CJ, et al. Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Dec 8;(12):CD005305.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005305.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27930803?tool=bestpractice.com
]What are the effects of pulmonary rehabilitation after exacerbation in people with chronic obstructive pulmonary disease?https://cochranelibrary.com/cca/doi/10.1002/cca.1650/full展示答案 有证据支持在急性加重 1 个月内开始肺康复。[192]Marciniuk DD, Brooks D, Butcher S, et al. Canadian Thoracic Society COPD Committee Expert Working Group. Optimizing pulmonary rehabilitation in chronic obstructive pulmonary disease - practical issues: a Canadian Thoracic Society Clinical Practice Guideline. Can Respir J. 2010 Jul-Aug;17(4):159-68.http://www.ncbi.nlm.nih.gov/pubmed/20808973?tool=bestpractice.com[193]Puhan MA, Gimeno-Santos E, Cates CJ, et al. Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Dec 8;(12):CD005305.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005305.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27930803?tool=bestpractice.com
美国一项大型队列研究发现,出院 90 日内开始肺康复,与 1 年死亡率降低和 1 年再住院率降低具有显著相关性。[194]Lindenauer PK, Stefan MS, Pekow PS, et al. Association between initiation of pulmonary rehabilitation after hospitalization for COPD and 1-year survival among medicare beneficiaries. JAMA. 2020 May 12;323(18):1813-23.https://jamanetwork.com/journals/jama/fullarticle/2765730http://www.ncbi.nlm.nih.gov/pubmed/32396181?tool=bestpractice.com[195]Stefan MS, Pekow PS, Priya A, et al. Association between initiation of pulmonary rehabilitation and rehospitalizations in patients hospitalized with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2021 Nov 1;204(9):1015-23.https://www.atsjournals.org/doi/10.1164/rccm.202012-4389OChttp://www.ncbi.nlm.nih.gov/pubmed/34283694?tool=bestpractice.com 只有不到 2% 的患者队列在此时间范围内起始康复治疗,突出表明需要制定更有效的策略鼓励患者参与。[194]Lindenauer PK, Stefan MS, Pekow PS, et al. Association between initiation of pulmonary rehabilitation after hospitalization for COPD and 1-year survival among medicare beneficiaries. JAMA. 2020 May 12;323(18):1813-23.https://jamanetwork.com/journals/jama/fullarticle/2765730http://www.ncbi.nlm.nih.gov/pubmed/32396181?tool=bestpractice.com 然而,出院前开始进行肺康复,可能与 12 个月死亡率升高具有相关性,因此不受推荐。[196]Greening NJ, Williams JE, Hussain SF, et al. An early rehabilitation intervention to enhance recovery during hospital admission for an exacerbation of chronic respiratory disease: randomised controlled trial. BMJ. 2014 Jul 8;349:g4315.https://www.bmj.com/content/349/bmj.g4315http://www.ncbi.nlm.nih.gov/pubmed/25004917?tool=bestpractice.com
肺康复亦可减少 COPD 相关性抑郁和焦虑,降低住院率。[197]Casaburi R, ZuWallack R. Pulmonary rehabilitation for management of chronic obstructive pulmonary disease. N Engl J Med. 2009 Mar 26;360(13):1329-35.http://www.ncbi.nlm.nih.gov/pubmed/19321869?tool=bestpractice.com
训练课程终止后,肺康复获益似乎有所消退,除非患者继续进行家庭训练计划。[198]Guell R, Casan P, Belda J, et al. Long-term effects of outpatient rehabilitation of COPD: a randomized trial. Chest. 2000 Apr;117(4):976-83.http://www.ncbi.nlm.nih.gov/pubmed/10767227?tool=bestpractice.com 维持性肺康复,被定义为以低于原康复项目频率的持续监督下运动,可能有助于长期保持肺康复的益处。Cochrane 评价结果表明,与常规诊疗相比,监督下的运动维持项目可能改善 6-12 个月时健康相关的生存质量和运动能力。[199]Malaguti C, Dal Corso S, Janjua S, et al. Supervised maintenance programmes following pulmonary rehabilitation compared to usual care for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Aug 17;(8):CD013569.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013569.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/34404111?tool=bestpractice.com [  ]For people with chronic obstructive pulmonary disease (COPD), what are the effects of a supervised maintenance program after pulmonary rehabilitation?https://www.cochranelibrary.com/cca/doi/10.1002/cca.4228/full展示答案
]For people with chronic obstructive pulmonary disease (COPD), what are the effects of a supervised maintenance program after pulmonary rehabilitation?https://www.cochranelibrary.com/cca/doi/10.1002/cca.4228/full展示答案
家庭或社区肺康复治疗对于 COPD 患者呼吸系统症状和生活质量的益处与医院康复治疗项目相当。[200]Maltais F, Bourbeau J, Shapiro S, et al. Effects of home-based pulmonary rehabilitation in patients with chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med. 2008 Dec 16;149(12):869-78.http://www.ncbi.nlm.nih.gov/pubmed/19075206?tool=bestpractice.com[201]Neves LF, Reis MH, Gonçalves TR. Home or community-based pulmonary rehabilitation for individuals with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Cad Saude Publica. 2016 Jun 20;32(6):S0102-311X2016000602001.http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-311X2016000602001&lng=en&nrm=iso&tlng=enhttp://www.ncbi.nlm.nih.gov/pubmed/27333130?tool=bestpractice.com[202]Holland AE, Mahal A, Hill CJ, et al. Home-based rehabilitation for COPD using minimal resources: a randomised, controlled equivalence trial. Thorax. 2017 Jan;72(1):57-65.https://thorax.bmj.com/content/72/1/57http://www.ncbi.nlm.nih.gov/pubmed/27672116?tool=bestpractice.com 一项 Cochrane 评价得出结论,初级和维持远程康复治疗实现了与当面康复治疗相似的结局,且无安全问题。该评价的局限性在于远程康复模型不同且受试者较少。[203]Cox NS, Dal Corso S, Hansen H, et al. Telerehabilitation for chronic respiratory disease. Cochrane Database Syst Rev. 2021 Jan 29;(1):CD013040.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013040.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/33511633?tool=bestpractice.com
氧疗和通气支持
GOLD 指南推荐对符合下列条件的稳定患者使用长期氧疗:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/
美国胸科学会(American Thoracic Society, ATS)指南建议,对于患有重度慢性静息性室内空气低氧血症的 COPD 成人,建议给予长期氧疗,每天至少给氧 15 小时。ATS 将重度低氧血症定义为(以下两者任一):[204]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]https://www.atsjournals.org/doi/10.1164/rccm.202009-3608SThttp://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
对于接受家庭氧疗的患者,ATS 建议患者及其照护者应接受所有氧气设备使用和维护的指导和培训,以及接受用氧安全教育,包括戒烟、防火和绊倒风险。[204]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]https://www.atsjournals.org/doi/10.1164/rccm.202009-3608SThttp://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
辅助供氧应滴定至实现 SaO₂ ≥90%。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 60-90 天后应对患者进行再评估,确定给氧是否仍有指征,并仍具有治疗作用。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 在 COPD 多个不同的治疗方法中,只有两个因素可以改善存活情况,即戒烟和氧疗。
氧疗有助于通过降低肺动脉压力而最大程度减低肺动脉高压,改善运动耐量,以及提高生活质量。已经证明它能改善生存情况。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[61]Qaseem A, Wilt TJ, Weinberger SE, et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Ann Intern Med. 2011 Aug 2;155(3):179-91.https://www.acpjournals.org/doi/10.7326/0003-4819-155-3-201108020-00008http://www.ncbi.nlm.nih.gov/pubmed/21810710?tool=bestpractice.com
一些证据表明,运动时为轻度低氧血症和非低氧血症 COPD 患者(平时未达到家庭氧疗标准的患者)吸氧可缓解呼吸困难。[205]Ekström M, Ahmadi Z, Bornefalk-Hermansson A, et al. Oxygen for breathlessness in patients with chronic obstructive pulmonary disease who do not qualify for home oxygen therapy. Cochrane Database Syst Rev. 2016 Nov 25;(11):CD006429.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD006429.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27886372?tool=bestpractice.com ATS 建议对伴 COPD 的重度劳力性室内空气低氧血症成人,进行动态给氧(活动或日常生活时给氧)。[204]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]https://www.atsjournals.org/doi/10.1164/rccm.202009-3608SThttp://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com 但 ATS 建议,对于有中度慢性休息室空气低氧血症(SpO₂ 为 89%-93%)的 COPD 成人,勿给予长期氧疗。[204]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]https://www.atsjournals.org/doi/10.1164/rccm.202009-3608SThttp://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
大多数接受长期氧疗的患者可以安全进行航空旅行,但患者应具备忍受短期不吸氧的能力,因为有时可能不具备供氧条件。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[206]British Thoracic Society. Air travel. Mar 2022 [internet publication].https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel/ 海平面 SaO₂ >95%,6 分钟步行试验后 SaO₂ ≥84% 的患者,可无需进一步评估即乘坐飞机旅行。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[206]British Thoracic Society. Air travel. Mar 2022 [internet publication].https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel/[207]Edvardsen A, Akerø A, Christensen CC, et al. Air travel and chronic obstructive pulmonary disease: a new algorithm for pre-flight evaluation. Thorax. 2012 Nov;67(11):964-9.https://thorax.bmj.com/content/67/11/964http://www.ncbi.nlm.nih.gov/pubmed/22767877?tool=bestpractice.com 海平面 SaO₂ 92% 至 95%,且 6 分钟步行试验后 SaO₂ <84% 者,以及海平面 SaO₂ <92% 者,建议给予辅助供氧。[207]Edvardsen A, Akerø A, Christensen CC, et al. Air travel and chronic obstructive pulmonary disease: a new algorithm for pre-flight evaluation. Thorax. 2012 Nov;67(11):964-9.https://thorax.bmj.com/content/67/11/964http://www.ncbi.nlm.nih.gov/pubmed/22767877?tool=bestpractice.com 应对其他患者进行高原低氧模拟检查(也称为低氧激发试验)。[206]British Thoracic Society. Air travel. Mar 2022 [internet publication].https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel/[207]Edvardsen A, Akerø A, Christensen CC, et al. Air travel and chronic obstructive pulmonary disease: a new algorithm for pre-flight evaluation. Thorax. 2012 Nov;67(11):964-9.https://thorax.bmj.com/content/67/11/964http://www.ncbi.nlm.nih.gov/pubmed/22767877?tool=bestpractice.com 对于接受长期氧疗的患者,英国胸科协会建议考虑在飞行途中吸氧,氧流量较患者平时处方流量高 2 L/min。[206]British Thoracic Society. Air travel. Mar 2022 [internet publication].https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel/
罹患 COPD 和阻塞性睡眠呼吸暂停的患者,采用持续气道正压通气(continuous positive airway pressure, CPAP)进行通气支持,可改善生存率,并减少住院率。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[67]Marin JM, Soriano JB, Carrizo SJ, et al. Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea: the overlap syndrome. Am J Respir Crit Care Med. 2010 Aug 1;182(3):325-31.https://www.atsjournals.org/doi/10.1164/rccm.200912-1869OChttp://www.ncbi.nlm.nih.gov/pubmed/20378728?tool=bestpractice.com 尽管起始治疗的最佳时机,以及选择适合患者的最佳标准尚未明确,但无创通气(non-invasive ventilation, NIV)偶用于病情非常严重但稳定的 COPD 患者。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[208]Wilson ME, Dobler CC, Morrow AS, et al. Association of home noninvasive positive pressure ventilation with clinical outcomes in chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA. 2020 Feb 4;323(5):455-65.https://jamanetwork.com/journals/jama/fullarticle/2760390http://www.ncbi.nlm.nih.gov/pubmed/32016309?tool=bestpractice.com[209]Raveling T, Vonk J, Struik FM, et al. Chronic non-invasive ventilation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Aug 9;(8):CD002878.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002878.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/34368950?tool=bestpractice.com 一项 Cochrane 评价发现,通过面罩提供的长期 NIV 提高了生存率,并对稳定期 COPD 患者的短期健康相关生存质量有益。长期 NIV 还可改善急性加重后持续性高碳酸血症患者的院外生存期。[209]Raveling T, Vonk J, Struik FM, et al. Chronic non-invasive ventilation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Aug 9;(8):CD002878.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002878.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/34368950?tool=bestpractice.com 另一项研究报道称,与对照治疗相比,NIV 的急性加重出现率显著降低,但在死亡率、PaO2、PaCO2 或 pH 值等方面未观察到有所改善。[210]He X, Luo L, Ma Y, et al. Efficacy of domiciliary noninvasive ventilation on clinical outcomes in posthospital chronic obstructive pulmonary disease patients: a meta-analysis of randomized controlled trials. Ann Palliat Med. 2021 May;10(5):5137-45.http://www.ncbi.nlm.nih.gov/pubmed/33977751?tool=bestpractice.com
ATS 指南建议,对于稳定的有慢性高碳酸血症的 COPD 患者,在常规治疗基础上增加夜间 NIV。[211]Macrea M, Oczkowski S, Rochwerg B, et al. Long-term noninvasive ventilation in chronic stable hypercapnic chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice fuideline. Am J Respir Crit Care Med. 2020 Aug 15;202(4):e74-87.https://www.atsjournals.org/doi/10.1164/rccm.202006-2382SThttp://www.ncbi.nlm.nih.gov/pubmed/32795139?tool=bestpractice.com 欧洲呼吸学会和加拿大胸科协会已发布相似指南。[212]Ergan B, Oczkowski S, Rochwerg B, et al. European Respiratory Society guidelines on long-term home non-invasive ventilation for management of COPD. Eur Respir J. 2019 Sep 28;54(3):1901003.https://erj.ersjournals.com/content/54/3/1901003http://www.ncbi.nlm.nih.gov/pubmed/31467119?tool=bestpractice.com[213]Kaminska M, Rimmer KP, McKim DA, et al. Long-term non-invasive ventilation in patients with chronic obstructive pulmonary disease (COPD): 2021 Canadian Thoracic Society clinical practice guideline update. Can J Respir Crit Care Sleep Med. 2021 May 7;5(3):160-83.https://www.tandfonline.com/doi/full/10.1080/24745332.2021.1911218
手术
手术干预是 COPD 治疗的最后一步,包括肺大疱切除术、肺减容术和肺移植。[214]van Agteren JE, Hnin K, Grosser D, et al. Bronchoscopic lung volume reduction procedures for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Feb 23;(2):CD012158.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012158.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/28230230?tool=bestpractice.com[215]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com [  ]How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?https://cochranelibrary.com/cca/doi/10.1002/cca.1680/full展示答案 这些手术是用于改善肺动力学、运动依从性和生活质量。[215]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com 气流受限非常严重的患者需接受肺减容术,特别是局限性上叶病变且运动耐量低于正常的患者。[214]van Agteren JE, Hnin K, Grosser D, et al. Bronchoscopic lung volume reduction procedures for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Feb 23;(2):CD012158.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012158.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/28230230?tool=bestpractice.com [
]How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?https://cochranelibrary.com/cca/doi/10.1002/cca.1680/full展示答案 这些手术是用于改善肺动力学、运动依从性和生活质量。[215]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com 气流受限非常严重的患者需接受肺减容术,特别是局限性上叶病变且运动耐量低于正常的患者。[214]van Agteren JE, Hnin K, Grosser D, et al. Bronchoscopic lung volume reduction procedures for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Feb 23;(2):CD012158.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012158.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/28230230?tool=bestpractice.com [  ]How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?https://cochranelibrary.com/cca/doi/10.1002/cca.1680/full展示答案 一项荟萃分析发现,与标准治疗相比,接受肺减容术的患者早期死亡风险增加;然而,观察到总体死亡率差异无统计学意义。[216]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com 对于存在呼吸困难且 CT 检查发现巨型肺大疱占据胸腔容积至少 30% 的 COPD 患者,可采取肺大疱切除术。严重的功能状态不良和 FEV₁ 重度下降 (<500 mL) 使得这些方案不太有利。对于经适当选择的 COPD 患者,支气管内活瓣置入术可带来有临床意义的改善。[216]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com[217]Klooster K, Slebos DJ, Zoumot Z, et al. Endobronchial valves for emphysema: an individual patient-level reanalysis of randomised controlled trials. BMJ Open Respir Res. 2017 Nov 2;4(1):e000214.https://bmjopenrespres.bmj.com/content/4/1/e000214http://www.ncbi.nlm.nih.gov/pubmed/29441206?tool=bestpractice.com[218]Labarca G, Uribe JP, Pacheco C, et al. Bronchoscopic lung volume reduction with endobronchial zephyr valves for severe emphysema: a systematic review and meta-analysis. Respiration. 2019 May 22;98(3):268-78.http://www.ncbi.nlm.nih.gov/pubmed/31117102?tool=bestpractice.com该手术可能对主要由终末细支气管远端气腔过度充气和气体滞留所致呼吸困难的患者(表现为肺气肿伴残气量显著增加)最有益。禁忌证包括活动性肺感染和不完全肺叶裂(<80%)。[219]Abia-Trujillo D, Johnson MM, Patel NM, et al. Bronchoscopic lung volume reduction: a new hope for patients with severe emphysema and air trapping. Mayo Clin Proc. 2021 Feb;96(2):464-72.http://www.ncbi.nlm.nih.gov/pubmed/32829903?tool=bestpractice.com 支气管内活瓣置入术相关性最常见不良事件为气胸和急性加重。[216]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
]How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?https://cochranelibrary.com/cca/doi/10.1002/cca.1680/full展示答案 一项荟萃分析发现,与标准治疗相比,接受肺减容术的患者早期死亡风险增加;然而,观察到总体死亡率差异无统计学意义。[216]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com 对于存在呼吸困难且 CT 检查发现巨型肺大疱占据胸腔容积至少 30% 的 COPD 患者,可采取肺大疱切除术。严重的功能状态不良和 FEV₁ 重度下降 (<500 mL) 使得这些方案不太有利。对于经适当选择的 COPD 患者,支气管内活瓣置入术可带来有临床意义的改善。[216]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com[217]Klooster K, Slebos DJ, Zoumot Z, et al. Endobronchial valves for emphysema: an individual patient-level reanalysis of randomised controlled trials. BMJ Open Respir Res. 2017 Nov 2;4(1):e000214.https://bmjopenrespres.bmj.com/content/4/1/e000214http://www.ncbi.nlm.nih.gov/pubmed/29441206?tool=bestpractice.com[218]Labarca G, Uribe JP, Pacheco C, et al. Bronchoscopic lung volume reduction with endobronchial zephyr valves for severe emphysema: a systematic review and meta-analysis. Respiration. 2019 May 22;98(3):268-78.http://www.ncbi.nlm.nih.gov/pubmed/31117102?tool=bestpractice.com该手术可能对主要由终末细支气管远端气腔过度充气和气体滞留所致呼吸困难的患者(表现为肺气肿伴残气量显著增加)最有益。禁忌证包括活动性肺感染和不完全肺叶裂(<80%)。[219]Abia-Trujillo D, Johnson MM, Patel NM, et al. Bronchoscopic lung volume reduction: a new hope for patients with severe emphysema and air trapping. Mayo Clin Proc. 2021 Feb;96(2):464-72.http://www.ncbi.nlm.nih.gov/pubmed/32829903?tool=bestpractice.com 支气管内活瓣置入术相关性最常见不良事件为气胸和急性加重。[216]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
肺移植转诊标准包括:[220]Leard LE, Holm AM, Valapour M, et al. Consensus document for the selection of lung transplant candidates: an update from the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2021 Nov;40(11):1349-79.https://www.jhltonline.org/article/S1053-2498(21)02407-4/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/34419372?tool=bestpractice.com
体重指数、气流阻塞、呼吸困难和运动(即 Body mass index, Airflow Obstruction, Dyspnoea, Exercise,统称为 BODE)指数为 5-6 伴其他因素,表明死亡风险升高:
频繁急性加重
过去 24 个月 BODE 指数增加 >1
CT 扫描显示肺动脉与主动脉直径比>1
FEV₁ 为 20%-25% 预测值
尽管给予了最大程度治疗,包括药物治疗、肺康复、氧疗和酌情进行夜间无创正压通气,但仍呈现临床恶化
生活质量低劣,患者无法接受
对于适合进行支气管镜或手术肺减容(lung volume reduction, LVR)的患者,可同时转诊进行肺移植和 LVR 评估
预测慢性阻塞性肺疾病 (COPD) 患者生存期的 BODE 指数
肺移植可以改善生活质量和功能容量。[215]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com 但是,肺移植似乎不能产生生存获益。[221]Stavem K, Bjørtuft Ø, Borgan Ø, et al. Lung transplantation in patients with chronic obstructive pulmonary disease in a national cohort is without obvious survival benefit. J Heart Lung Transplant. 2006 Jan;25(1):75-84.http://www.ncbi.nlm.nih.gov/pubmed/16399534?tool=bestpractice.com
缓和医疗(亦称为安宁疗护)
使用缓和治疗来改善呼吸困难症状、提供营养支持、治疗焦虑和抑郁以及减轻疲劳,可能对接受最佳药物治疗后仍有这些问题的 COPD 患者有益。 对于极晚期 COPD 患者,应考虑临终关怀和安宁疗护。应该对患者和家属进行疾病进程的教育,并建议在疾病早期,尚未发展成急性呼吸衰竭前进行讨论。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/[222]Janssen DJA, Bajwah S, Boon MH, et al. European Respiratory Society clinical practice guideline: palliative care for people with COPD or interstitial lung disease. Eur Respir J. 2023 Aug;62(2):2202014.https://erj.ersjournals.com/content/62/2/2202014http://www.ncbi.nlm.nih.gov/pubmed/37290789?tool=bestpractice.com 阿片类镇痛药、扇风、神经肌肉电刺激和胸壁振动疗法可缓解呼吸困难。[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2024 report. 2024 [internet publication].https://goldcopd.org/2024-gold-report/ 一项研究显示低剂量阿片类镇痛药和苯二氮䓬类是安全的,与住院率和死亡率的增加无关。[223]Ekström MP, Bornefalk-Hermansson A, Abernethy AP, et al. Safety of benzodiazepines and opioids in very severe respiratory disease: national prospective study. BMJ. 2014 Jan 30;348:g445.https://www.bmj.com/content/348/bmj.g445.longhttp://www.ncbi.nlm.nih.gov/pubmed/24482539?tool=bestpractice.com 另一项研究发现,常规、低剂量、口服缓释吗啡 4 周,可改善 COPD 和难治性呼吸困难患者的疾病特异性健康状况。[224]Verberkt CA, van den Beuken-van Everdingen MHJ, Schols JMGA, et al. Effect of sustained-release morphine for refractory breathlessness in chronic obstructive pulmonary disease on health status: a randomized clinical trial. JAMA Intern Med. 2020 Oct 1;180(10):1306-14.https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2769373http://www.ncbi.nlm.nih.gov/pubmed/32804188?tool=bestpractice.com
一项 Cochrane 评价得出结论,没有证据支持或反对苯二氮卓类药物可缓解晚期癌症患者和 COPD 患者的呼吸困难。[225]Simon ST, Higginson IJ, Booth S, et al. Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. Cochrane Database Syst Rev. 2016 Oct 20;(10):CD007354.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD007354.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27764523?tool=bestpractice.com
针刺和指压亦可对晚期 COPD 患者的呼吸困难和生活质量加以改善。[226]von Trott P, Oei SL, Ramsenthaler C. Acupuncture for breathlessness in advanced diseases: a systematic review and meta-analysis. J Pain Symptom Manage. 2020 Feb;59(2):327-38.e3.http://www.ncbi.nlm.nih.gov/pubmed/31539602?tool=bestpractice.com
 ][证据 A]
][证据 A] [Figure caption and citation for the preceding image starts]: COPD 的初始药物治疗 慢性阻塞性肺疾病全球倡议(GOLD):慢性阻塞性肺疾病诊断、治疗及预防全球策略(2023 年报告);获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: COPD 的初始药物治疗 慢性阻塞性肺疾病全球倡议(GOLD):慢性阻塞性肺疾病诊断、治疗及预防全球策略(2023 年报告);获准使用 [Citation ends]. [Figure caption and citation for the preceding image starts]: COPD 患者的升级治疗。缩略词含义:ICS——吸入皮质类固醇;LABA——长效 β2 受体激动剂;LAMA——长效毒蕈碱受体拮抗剂 慢性阻塞性肺疾病全球倡议(GOLD):慢性阻塞性肺疾病诊断、治疗及预防全球策略(2023 年报告);获准使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: COPD 患者的升级治疗。缩略词含义:ICS——吸入皮质类固醇;LABA——长效 β2 受体激动剂;LAMA——长效毒蕈碱受体拮抗剂 慢性阻塞性肺疾病全球倡议(GOLD):慢性阻塞性肺疾病诊断、治疗及预防全球策略(2023 年报告);获准使用 [Citation ends]. ] 如阿地溴铵、格隆溴铵、乌美铵等新一代 LAMA,对于改变 FEV₁ 谷值基线、过渡呼吸困难指数焦点评分、St George 呼吸问卷评分和抢救药物使用,具有与噻托溴铵至少相当的效力。[94] revefenacin 是一种雾化用 LAMA,获批用于中至重度 COPD 的维持治疗。一些关于使用短效毒蕈碱受体拮抗剂患者的研究和使用 LAMA 患者的研究发现,心血管相关死亡率有所增加。[95][96] 一项研究得出结论,与安慰剂相比,阿地溴铵与主要不良心血管事件的增加无关。[97] 一项基于人群的队列研究发现,最近开始接受 LAMA 治疗的 COPD 老年男性患者发生泌尿道感染的风险增加。[98]
] 如阿地溴铵、格隆溴铵、乌美铵等新一代 LAMA,对于改变 FEV₁ 谷值基线、过渡呼吸困难指数焦点评分、St George 呼吸问卷评分和抢救药物使用,具有与噻托溴铵至少相当的效力。[94] revefenacin 是一种雾化用 LAMA,获批用于中至重度 COPD 的维持治疗。一些关于使用短效毒蕈碱受体拮抗剂患者的研究和使用 LAMA 患者的研究发现,心血管相关死亡率有所增加。[95][96] 一项研究得出结论,与安慰剂相比,阿地溴铵与主要不良心血管事件的增加无关。[97] 一项基于人群的队列研究发现,最近开始接受 LAMA 治疗的 COPD 老年男性患者发生泌尿道感染的风险增加。[98] ][证据 A] 对于稳定期 COPD 患者,如果决定采取单药治疗,LAMA 可能优于 LABA。[99] 对于中至极重度 COPD 患者,与 LABA 相比,LAMA 能更有效地减少加重。[100][101] UPLIFT 试验证明了 LAMA 的长期安全性。[102]
][证据 A] 对于稳定期 COPD 患者,如果决定采取单药治疗,LAMA 可能优于 LABA。[99] 对于中至极重度 COPD 患者,与 LABA 相比,LAMA 能更有效地减少加重。[100][101] UPLIFT 试验证明了 LAMA 的长期安全性。[102] ] 一项系统评价和网络荟萃分析发现,所有 LABA/LAMA 固定剂量复方制剂都具有相似的有效性和安全性。[109]
] 一项系统评价和网络荟萃分析发现,所有 LABA/LAMA 固定剂量复方制剂都具有相似的有效性和安全性。[109] ] 与使用布地奈德相比,使用氟替卡松的这种风险更高。[116][117][118] 一项有关丹麦患者的大型队列研究发现,感染铜绿假单胞菌(医院获得性肺炎的常见原因)风险具有剂量依赖性,其中高剂量 ICS 的风险大。该研究还发现,与铜绿假单胞菌阴性患者相比,感染铜绿假单胞菌患者的 BMI 和 FEV₁ 更可能较低。[119] 一项系统评价和荟萃分析发现,尽管使用 ICS 与未经调整的肺炎风险显著增加有关,但在随机对照临床试验中,ICS 并未引起肺炎致死率和总体死亡率增加,在一些观察性研究中肺炎致死率和总体死亡率反而有所降低。[120] 因此,应该评估肺炎的风险和减少急性加重的获益来实施个体化治疗。[79][121][122] 接受 ICS 治疗的 COPD 成人患者中,结核病和流感风险的升高也引发了关注,但一项荟萃分析发现,所有经评估的结核病病例中,仅不到 1% 的病例可归因于 ICS 暴露。[123][124] ICS 也可能引起口咽念珠菌病病和声音嘶哑。[79] [
] 与使用布地奈德相比,使用氟替卡松的这种风险更高。[116][117][118] 一项有关丹麦患者的大型队列研究发现,感染铜绿假单胞菌(医院获得性肺炎的常见原因)风险具有剂量依赖性,其中高剂量 ICS 的风险大。该研究还发现,与铜绿假单胞菌阴性患者相比,感染铜绿假单胞菌患者的 BMI 和 FEV₁ 更可能较低。[119] 一项系统评价和荟萃分析发现,尽管使用 ICS 与未经调整的肺炎风险显著增加有关,但在随机对照临床试验中,ICS 并未引起肺炎致死率和总体死亡率增加,在一些观察性研究中肺炎致死率和总体死亡率反而有所降低。[120] 因此,应该评估肺炎的风险和减少急性加重的获益来实施个体化治疗。[79][121][122] 接受 ICS 治疗的 COPD 成人患者中,结核病和流感风险的升高也引发了关注,但一项荟萃分析发现,所有经评估的结核病病例中,仅不到 1% 的病例可归因于 ICS 暴露。[123][124] ICS 也可能引起口咽念珠菌病病和声音嘶哑。[79] [  ]
] ] 联合制剂应用方便,同时可能改善部分患者的依从性。这类药物治疗的选择取决于药物的可及性、个人反应和患者偏好。[127] 联合制剂可能由单独或联合吸入装置提供。
] 联合制剂应用方便,同时可能改善部分患者的依从性。这类药物治疗的选择取决于药物的可及性、个人反应和患者偏好。[127] 联合制剂可能由单独或联合吸入装置提供。 ]
] ] 目前尚无数据显示长期使用阿奇霉素治疗超过 1 年的有效性或安全性。
] 目前尚无数据显示长期使用阿奇霉素治疗超过 1 年的有效性或安全性。 ] 改善体力活动的最佳时机、因素、持续时间和模式尚不清楚。荟萃分析表明,瑜伽、气功和其他居家呼吸练习可改善 COPD 患者的运动能力和肺功能。[170][171][172] 研究显示,与常规治疗相比,太极拳可改善运动能力。[173]
] 改善体力活动的最佳时机、因素、持续时间和模式尚不清楚。荟萃分析表明,瑜伽、气功和其他居家呼吸练习可改善 COPD 患者的运动能力和肺功能。[170][171][172] 研究显示,与常规治疗相比,太极拳可改善运动能力。[173] ] 美国疾病预防控制中心(Centers for Disease Control and Prevention, CDC)指南建议,对于既往未曾接受 PCV 或疫苗接种史未知的所有 COPD 患者,应接种单剂 15 价肺炎球菌结合疫苗(15-valent pneumococcal conjugate vaccine, PCV15)或 20 价 PCV(20-valent PCV, PCV20)。接种 PCV15 的患者应在至少一年后接种单剂 23 价多糖疫苗(23-valent polysaccharide vaccine, PPSV23)。[184]
] 美国疾病预防控制中心(Centers for Disease Control and Prevention, CDC)指南建议,对于既往未曾接受 PCV 或疫苗接种史未知的所有 COPD 患者,应接种单剂 15 价肺炎球菌结合疫苗(15-valent pneumococcal conjugate vaccine, PCV15)或 20 价 PCV(20-valent PCV, PCV20)。接种 PCV15 的患者应在至少一年后接种单剂 23 价多糖疫苗(23-valent polysaccharide vaccine, PPSV23)。[184] ] 它们可以使急性加重频率和每月出现失能的天数略微减少,但不能改善肺功能和生活质量。[186] 一项 meta 分析对厄多司坦、羧甲司坦和乙酰半胱氨酸进行了比较,得出的结论为,厄多司坦的安全性和有效性最好。厄多司坦降低了因急性加重而住院的风险,它和乙酰半胱氨酸都缩短了急性加重的持续时间。[187] 另一项荟萃分析发现,与安慰剂相比,乙酰半胱氨酸可显著降低急性加重发病率,而不良反应风险未见升高。作者得出结论,3 个月低剂量治疗具有疗效。[188] 厄多司坦和羧甲司坦在美国和部分其他国家尚无法使用。使用化痰药物(例如羧甲司坦和乙酰半胱氨酸)进行治疗,可减少未接受 ICS 的患者发生急性加重,并适度改善健康状况。[1] 但是,无论患者是否正在使用 ICS,厄多司坦对于轻度加重具有显著效果。[1]
] 它们可以使急性加重频率和每月出现失能的天数略微减少,但不能改善肺功能和生活质量。[186] 一项 meta 分析对厄多司坦、羧甲司坦和乙酰半胱氨酸进行了比较,得出的结论为,厄多司坦的安全性和有效性最好。厄多司坦降低了因急性加重而住院的风险,它和乙酰半胱氨酸都缩短了急性加重的持续时间。[187] 另一项荟萃分析发现,与安慰剂相比,乙酰半胱氨酸可显著降低急性加重发病率,而不良反应风险未见升高。作者得出结论,3 个月低剂量治疗具有疗效。[188] 厄多司坦和羧甲司坦在美国和部分其他国家尚无法使用。使用化痰药物(例如羧甲司坦和乙酰半胱氨酸)进行治疗,可减少未接受 ICS 的患者发生急性加重,并适度改善健康状况。[1] 但是,无论患者是否正在使用 ICS,厄多司坦对于轻度加重具有显著效果。[1] ] 有证据支持在急性加重 1 个月内开始肺康复。[192][193]
] 有证据支持在急性加重 1 个月内开始肺康复。[192][193] ]
] ] 这些手术是用于改善肺动力学、运动依从性和生活质量。[215] 气流受限非常严重的患者需接受肺减容术,特别是局限性上叶病变且运动耐量低于正常的患者。[214] [
] 这些手术是用于改善肺动力学、运动依从性和生活质量。[215] 气流受限非常严重的患者需接受肺减容术,特别是局限性上叶病变且运动耐量低于正常的患者。[214] [  ] 一项荟萃分析发现,与标准治疗相比,接受肺减容术的患者早期死亡风险增加;然而,观察到总体死亡率差异无统计学意义。[216] 对于存在呼吸困难且 CT 检查发现巨型肺大疱占据胸腔容积至少 30% 的 COPD 患者,可采取肺大疱切除术。严重的功能状态不良和 FEV₁ 重度下降 (<500 mL) 使得这些方案不太有利。对于经适当选择的 COPD 患者,支气管内活瓣置入术可带来有临床意义的改善。[216][217][218]该手术可能对主要由终末细支气管远端气腔过度充气和气体滞留所致呼吸困难的患者(表现为肺气肿伴残气量显著增加)最有益。禁忌证包括活动性肺感染和不完全肺叶裂(<80%)。[219] 支气管内活瓣置入术相关性最常见不良事件为气胸和急性加重。[216]
] 一项荟萃分析发现,与标准治疗相比,接受肺减容术的患者早期死亡风险增加;然而,观察到总体死亡率差异无统计学意义。[216] 对于存在呼吸困难且 CT 检查发现巨型肺大疱占据胸腔容积至少 30% 的 COPD 患者,可采取肺大疱切除术。严重的功能状态不良和 FEV₁ 重度下降 (<500 mL) 使得这些方案不太有利。对于经适当选择的 COPD 患者,支气管内活瓣置入术可带来有临床意义的改善。[216][217][218]该手术可能对主要由终末细支气管远端气腔过度充气和气体滞留所致呼吸困难的患者(表现为肺气肿伴残气量显著增加)最有益。禁忌证包括活动性肺感染和不完全肺叶裂(<80%)。[219] 支气管内活瓣置入术相关性最常见不良事件为气胸和急性加重。[216]






